题目内容
【题目】聚苯乙烯塑料在生产、生活中有广泛应用,其单体可由乙苯和二氧化碳在一定条件下反应制得,其反应原理如下:

下列有关说法不正确的是
A. 苯乙烯可通过加聚反生成聚苯乙烯
B. 苯乙烯分子中所有原子可能共平面
C. 乙苯、苯乙烯均能使溴水褪色,且其褪色原理相同
D. 等质量的聚苯乙烯与苯乙烯中所含的碳原子数相同
【答案】C
【解析】A.苯乙烯中含有碳碳双键,所以能发生加聚反应生成聚苯乙烯,故A正确;B.苯和乙烯都是平面结构,所有原子共平面,则苯乙烯分子中所有原子可以共平面,故B正确;C.乙苯具有的特殊结构,和溴水不发生反应,但能使溴水萃取褪色,苯乙烯和溴单质发生加成反应使溴水褪色,二者褪色原理不同,故C错误;D. 聚苯乙烯与苯乙烯的最简式相同,都是CH,等质量的聚苯乙烯与苯乙烯中所含的碳原子数相同,故D正确;故选C。

 考前必练系列答案
考前必练系列答案【题目】锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ、锂的原子结构示意图为___________;锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物____________(填化学式)。
Ⅱ、锂经常用于制作电池。锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
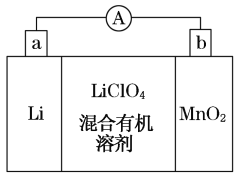
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式____________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),用化学反应方程式解释原因______________________________________________。
Ⅲ、下面是从锂辉石(Li2O·Al2O3·SiO2)中提取锂的工业流程示意图。
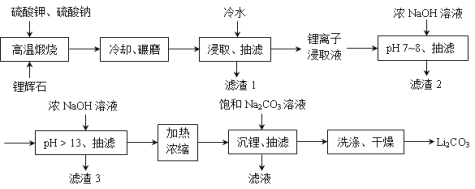
① 高温煅烧时的反应原理为:Li2OAl2O3SiO2+K2SO4= K2OAl2O3SiO2+Li2SO4;
Li2OAl2O3SiO2+Na2SO4= Na2OAl2O3SiO2+Li2SO4。
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
温度 溶解度 | 10 | 20 | 50 | 80 |
Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(1)浸取时使用冷水的原因是______________________________________。
(2)滤渣2的主要成分为__________________。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH > 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是__________________,用离子方程式表示其产生的原因_____________________________。
(4)洗涤Li2CO3晶体使用_____________。(填“冷水”或“热水”)