题目内容
工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用相同条件下的NH3 3L恰好反应完全,则混合气中NO与NO2的体积分数比
| A.l:4 | B.1:3 | C.l:2 | D.l:l |
D
解析试题分析:氮氧化物与氨气发生的反应是氧化还原反应,氮氧化物把氨气氧化为氮气,本身被还原为氮气,可以根据氧化还原反应的电子守恒计算;氨气被氧化为氮气,NH3~1/2N2~3e-;一氧化氮被还原为氮气,NO~1/2N2~2e-二氧化氮被还原为氮气NO2~1/2N2~4e-,设一氧化氮体积为x,二氧化氮体积为3-x,氨气的体积为3L,根据电子守恒可知:3L×3=2x+4(3-x),x=1.5L,二氧化氮体积为1.5L,则相同条件下,混合气体中NO和NO2的体积比等于物质的量之比为1:1;选D。
考点:考查氧化还原反应的计算、电子守恒法。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案设NA表示阿伏加德罗常数的值,下列表述不正确的是( )
| A.标准状况下,22.4L氢气所含原子数是2NA |
| B.5.4g水所含的分子数为0.3NA |
| C.含1mol硫酸钾的溶液中硫酸根离子数为2NA |
| D.1mol金属钠与水反应失去的电子数为NA |
NA表示阿伏加德罗常数,下列说法正确的是
| A.常温常压下,32g O2含有的原子数为2NA |
| B.100mL 1mol·L-1氨水中,含有OH- 离子数是0.1 NA |
| C.100mL 2 mol·L-1碳酸钠溶液中,CO2-3离子数为0.2NA |
| D.标准状况下,22.4LCl2通入足量NaOH溶液,转移的电子数为2NA |
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子。则该硫酸盐的物质的量浓度为(NA表示阿佛加德罗常数的值)
| A.1mol·L-1 | B.2.5 mol·L-1 | C.5 mol·L-1 | D.2 mol·L-1 |
下列说法不正确的是
| A.在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B.一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C.100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl— 的个数为0.6×6.02×1023 |
| D.含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
下列物质的化学用语正确的是
①NH4H的电子式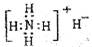
②硝基苯的结构简式: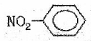
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型: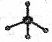
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子: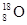
⑦sp2杂化轨道模型: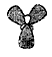
| A.②③⑤ | B.①③⑤⑥ | C.③⑥⑦ | D.②③⑥⑦ |
v L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.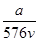 mol·L-1 mol·L-1 | B.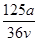 mol·L-1 mol·L-1 |
C.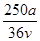 mol·L-1 mol·L-1 | D.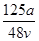 mol·L-1 mol·L-1 |
5g的钠、镁、铝、铁分别与1mol/L的盐酸100mL反应,产生气体的体积:
| A.铝最多 | B.钠最多 | C.一样多 | D.无法判断 |
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是
| A.150 mL 1 mol·L-1的NaCl溶液 |
| B.75 mL 2 mol·L-1 NH4Cl溶液 |
| C.150 mL 2 mol·L-1的KCl溶液 |
| D.75 mL 1 mol·L-1的FeCl3溶液 |