题目内容
【题目】将0.34 g Cu和CuO的混合物加入约12 mol·L-1浓硫酸中,并加热使其完全溶解,然后用NaOH溶液中和过量硫酸,再用水稀释到0.5 L,加入纯铁粉1.85 g,反应后过滤、干燥,得不溶物1.89 g。求置换出的铜的质量及原混合物中铜的质量分数___________。
【答案】置换出的铜的质量为0.32 g,原混合物中铜的质量分数约为70.59%。
【解析】
根据硫酸铜的反应方程式,运用差量法计算硫酸铜溶液中铜的质量,根据混合物的总质量及含铜的质量计算铜的质量分数。
设置换出的铜的质量为x
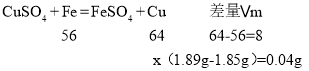
![]() 解得:x=0.32g;
解得:x=0.32g;
设混合物中Cu的质量为yg,则CuO为(0.34-y)g,其中含Cu![]() ,则0.32g=yg+
,则0.32g=yg+![]() ,解得:y=0.24,所以铜的质量分数为:
,解得:y=0.24,所以铜的质量分数为:![]() ,故答案为:置换出的铜的质量为0.32g,原混合物中铜的质量分数约为70.59%。
,故答案为:置换出的铜的质量为0.32g,原混合物中铜的质量分数约为70.59%。

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目