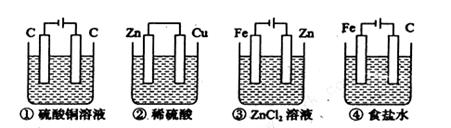
题目内容
燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质溶液是强碱。下面关于甲烷燃料电池的说法正确的是
| A.负极反应为:O2+2H2O+4e ==4OH-; |
| B.负极反应为:CH4+10OH- - 8e==CO32-+7H2O |
| C.放电时溶液中的阳离子向负极移动; |
| D.随放电的进行,溶液的pH值不变 |
B
燃料电池的构造为:燃料进入负极,氧气进入正极;所以
A错,负极反应式为: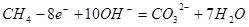 ;B正确;C错,放电时溶液中的阳离子向正极移动;D错,随放电的进行,碱不断被消耗,溶液的pH值将减小;
;B正确;C错,放电时溶液中的阳离子向正极移动;D错,随放电的进行,碱不断被消耗,溶液的pH值将减小;
A错,负极反应式为:
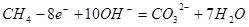 ;B正确;C错,放电时溶液中的阳离子向正极移动;D错,随放电的进行,碱不断被消耗,溶液的pH值将减小;
;B正确;C错,放电时溶液中的阳离子向正极移动;D错,随放电的进行,碱不断被消耗,溶液的pH值将减小;
练习册系列答案
相关题目
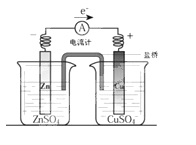

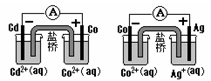
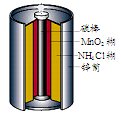
 溶液中的H+的物质的量浓度?(设溶液的体积不变)
溶液中的H+的物质的量浓度?(设溶液的体积不变) 2 Fe2++ I 2 设计成如图所示的原电池。下列判断不正确的是
2 Fe2++ I 2 设计成如图所示的原电池。下列判断不正确的是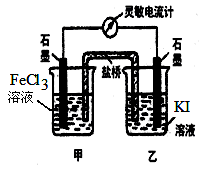
 读数为零时,反应达到化学平衡状态
读数为零时,反应达到化学平衡状态 浓度均为0.4 mol·L-1
浓度均为0.4 mol·L-1 ,工作一段时间后,测得导线上均通过了0.10mol电子,此时溶液中的pH由大到小的顺序是]
,工作一段时间后,测得导线上均通过了0.10mol电子,此时溶液中的pH由大到小的顺序是]