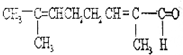题目内容
3. 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①写出电解饱和NaCl溶液总的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
②在X极附近观察到的现象是放出气体,溶液变红.检验Y电极反应产物的方法是把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色.
(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,则:
①X电极发生的反应类型为还原反应;电子的流向由Y到X(填X或Y).②Y电极的材料是粗铜,电极反应式为Cu-2e-=Cu2+.CuSO4溶液的浓度略有减少(填“不变”“略有增加”或“略有减少”).
分析 (1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝;
(2)根据电解精炼铜的工作原理知识来回答.
解答 解:(1)①用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,电解的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2 OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2 OH-+H2↑+Cl2↑;
②和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红;和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气能使湿润的碘化钾淀粉试纸变蓝,可以用于氯气的检验,
故答案为:放出气体,溶液变红;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,发生氧化反应,电子从Y电极经电源流向X电极,故答案为:还原反应; YX;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,主要电极反应为:Cu-2e-=Cu2+,另ZnFe等比Cu活泼的金属也会失电子生成金属阳离子,阴极只有铜离子得电子,硫酸铜溶液浓度降低,故答案为:粗铜;Cu-2e-=Cu2+;略有减少.
点评 本题考查学生电解池的工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.具备基本的实验技能是进行科学探究活动的基础.下列有关实验操作正确的是( )
| A. |  点燃洒精灯 | B. |  称量10.05g固体 | C. |  液体加热 | D. |  倾倒液体 |
11.在相同条件下,两种气体的物质的量相同,下列说法一定正确的是( )
| A. | 体积均为22.4 L | B. | 具有相同的体积 | ||
| C. | 具有相同的质量 | D. | 具有相同的原子数目 |
12.常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A. | MnO2 CuO FeO | B. | (NH4)2SO4 K2SO4 NH4Cl | ||
| C. | AgNO3 KNO3 Na2CO3 | D. | Na2CO3 NaHCO3 K2CO3 |