题目内容
8.(1)现有①铁片 ②熔融NaCl ③稀氨水 ④CH3COOH ⑤酒精 ⑥稀盐酸 ⑦H2SO4⑧KOH ⑨蔗糖 ⑩H2CO3,其中属于非电解质的是⑤⑨,属于强电解质的是②⑦⑧,属于弱电解质的是④(用序号填空),选择其中的一种弱电解质,写出其在水中的电离方程式CH3COOH?CH3COO-+H+ 或 H2CO3?H++HCO3-,HCO3-?H++CO32-.(2)实验室制取Fe(OH)3胶体的化学反应方程式可表示为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
分析 (1)电解质是在水溶液或熔融状态下能导电的化合物为电解质;在水溶液和熔融状态下都不能导电的化合物为非电解质;水溶液中全部电离的电解质为强电解质;水溶液中部分电离的电解质为弱电解质;依据物质组成和概念分析判断;
(2)将饱和三氯化铁溶液滴人沸水中来制取氢氧化铁胶体.
解答 解:①铁片是单质即不是电解质也不是非电解质;②熔融NaCl是强电解质;③稀氨水是混合物,即不是电解质也不是非电解质;④CH3COOH是电解质,在溶液中部分电离属于弱电解质;⑤酒精是非电解质;⑥盐酸是氯化氢的水溶液是电解质的水溶液; ⑦H2SO4是电解质,水溶液中全部电离属于强电解质;⑧KOH是电解质水溶液中完全电离属于强电解质;⑨蔗糖是非电解质;⑩H2CO3在水溶液中部分电离,属于弱电解质;综上所述分析判断:属于非电解质的是⑤⑨;属于电解质的是②⑦⑧;属于电解质的是:④⑩;弱电解质在水溶液中的电离方程式:CH3COOH?CH3COO-+H+ 或 H2CO3?H++HCO3-,HCO3-?H++CO32-;
故答案为:⑤⑨; ②⑦⑧;④;CH3COOH?CH3COO-+H+ 或 H2CO3?H++HCO3-,HCO3-?H++CO32-;
(2)加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,可以制得胶体,原理方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
点评 本题考查了物质的分类,物质性质的应用,电解质、非电解质、强电解质、弱电解质的概念分析应用,题目较简单.

 阅读快车系列答案
阅读快车系列答案| A. | 10mol | B. | 0.1mol | C. | 1mol | D. | 100mol |
| A. |  表示在其他条件不变时,2SO2 (g)+02 (g)?2S03 (g)转化关系中,纵坐标表示02的转化率 | |
| B. |  表示用0.1mol/L NaOH溶液分别滴定等浓度、等体积的盐酸和醋酸,其中实线为滴定醋酸的曲线 | |
| C. | 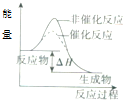 表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 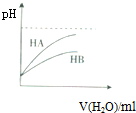 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则酸性HA<HB |
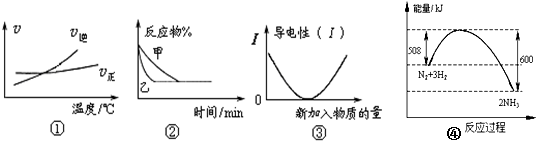
| A. | 根据图①可判断可逆反应 A2(g)+3B2(g)?2AB3(g) 的△H>0 | |
| B. | 图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 图④是N2与H2合成氨的能量变化曲线,则1 mol N2和4 mol H2充分反应时放热一定小于92 kJ |
| A. | Na+、K+、H+、SO42- | B. | Ba2+、Na+、NO3-、Cl- | ||
| C. | Na+、K+、S2-、CO32- | D. | Ba2+、Cu2+、NO3-、Cl- |
| A. | 22.4L | B. | 44.8L | C. | 67.2L | D. | 89.6L |

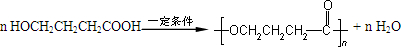 .
.
 .
. .
. 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题: