题目内容
【题目】为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验。已知无色气体B能形成酸雨。请回答:
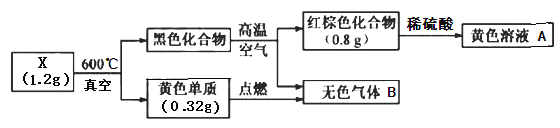
(1)X的化学式是________。
(2)设计实验方案检验黄色溶液中的金属阳离子___________________。
(3)将无色气体B通入黄色溶液A中,发现溶液变成浅绿色。请用离子方程式表示该反应_________
【答案】FeS2 取少量黄色溶液,滴加KSCN溶液,若变血红色,说明存在Fe3+ 2Fe3+ +SO2 + 2H2O=2Fe2+ +SO42- + 4H+
【解析】
X在真空中加热后生成黄色单质,该黄色单质在氧气中燃烧生成能形成酸雨的无色气体,则单质为S,无色气体为SO2;黑色固体在与氧气在高温条件下生成二氧化硫气体和红棕色化合物,该化合物溶于酸显黄色,可知该红棕色化合物为氧化铁,黄色溶液为硫酸铁溶液,褐色化合物黑色化合物由铁元素和硫元素组成,黑色化合物的质量=1.2g-0.32g=0.88g,红棕色化合物中铁的质量=0.8g×![]() =0.56g,则硫元素的质量=0.88g-0.56g=0.32g,所以铁原子和硫原子的个数比=
=0.56g,则硫元素的质量=0.88g-0.56g=0.32g,所以铁原子和硫原子的个数比=![]() ,所以黑色化合物的化学式为FeS,X中还有0.32g硫元素,所以X的化学式为FeS2。
,所以黑色化合物的化学式为FeS,X中还有0.32g硫元素,所以X的化学式为FeS2。
(1)X的化学式是FeS2;
(2)黄色溶液中的金属阳离子是三价铁离子,故检验方法是取少量黄色溶液,滴加KSCN溶液,若变血红色,说明存在Fe3+;
(3)将无色气体B通入黄色溶液A中,发现溶液变成浅绿色的离子方程式为2Fe3++SO2+ 2H2O=2Fe2++SO42-+4H+。

练习册系列答案
相关题目