��Ŀ����
����Ŀ����ͼ����ѧ��ѧ�г������ʵ�ת����ϵ���������ʺͷ�Ӧ������ȥ��
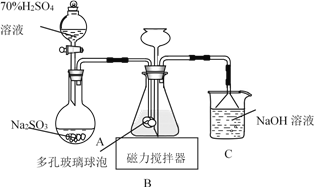
��ش��������⣺
(1)����A�Ļ�ѧʽΪ_____��
(2)д������B��ǿ����Һ��Ӧ�����ӷ���ʽ_____��������D��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ_____��
(3)��ҺE�м��백ˮʱ�������ɰ�ɫ����L��L���ձ�Ϊ���ɫ����G��д��L��ΪG�Ļ�ѧ��Ӧ����ʽ_____��
(4)��ҺE���ڷ������ױ��ʣ�д��������ҺE�Ƿ���ʵ�ʵ�������������_____��Ϊ�˷�ֹ��ҺE�ı��ʣ�������Һ�м���_____�������ӷ���ʽ˵��______________
(5) ��3.06 g����þ�Ļ�����ĩ����100 mL������,ǡ����ȫ��Ӧ,���õ���״����3.36 L H2����úϽ����������ʵ���_____,��Ӧ����Һ��Cl-�����ʵ���Ũ��_____(�ٶ���Ӧ�����Ϊ100 mL)
���𰸡� Fe2O3 2Al+2OH��+2H2O�T2AlO2��+3H2�� Al2O3+2NaOH�T2NaAlO2+H2O 4Fe��OH��2+O2+2H2O�T4Fe��OH��3 ȡ��ҺE�������Թ��У��μӼ���KSCN��Һ������Һ���ɫ��֤����ҺE�Ѿ����� ���� 2Fe3++Fe=3Fe2+ 0.06 mol 3.0 mol��L-1
��������
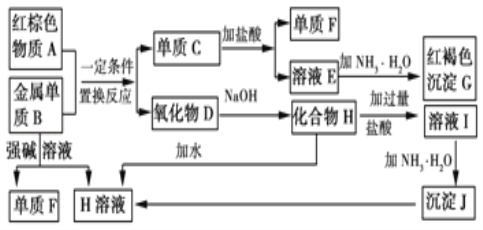
���ɫ����G����������������ת����ϵ��֪������C��Fe������F����������ҺE���Ȼ������������ɫ����A��Fe2O3������B���������Ʒ�Ӧ�ų���������B��������ҺH��ƫ�����ƣ������������������ȷ�Ӧ����������������D����������ƫ�����������ᷴӦ�����Ȼ�������ҺI���Ȼ���������J������������
�������Ϸ�����(1)����ɫ����A������������ѧʽΪFe2O3��
(2)����B��������ǿ����Һ��Ӧ����ƫ�����ƺ���������Ӧ�����ӷ���ʽ��2Al+2OH��+2H2O�T2AlO2��+3H2����������D������������������NaOH��Һ��Ӧ����ƫ�����ƣ���ѧ����ʽ��Al2O3+2NaOH�T2NaAlO2+H2O��
(3)�������ᷴӦ�����Ȼ���������������ҺE���Ȼ��������Ȼ�������Һ�м��백ˮʱ������������������������������������Ϊ������������Ӧ�Ļ�ѧ��Ӧ����ʽ��4Fe(OH)2+O2+2H2O�T4Fe(OH)3��
(4)�Ȼ��������ڷ������ױ���������Fe3+��Fe3+��KSCN��Һ��ΪѪ��ɫ��������Һ�Ȼ������Ƿ���ʵ�ʵ�������������Ϊ��ȡ��ҺE�������Թ��У��μӼ���KSCN��Һ������Һ���ɫ��֤����ҺE�Ѿ����ʡ��������ܰ�Fe3+��ԭΪFe2+��Ϊ�˷�ֹ��ҺE�ı��ʣ�������Һ�м������ۣ���Ӧ�����ӷ���ʽ��2Fe3++Fe=3Fe2+��
(5) ����þ�ֱ������ᷴӦ�Ļ�ѧ����ʽ��2Al+6HCl==2AlCl3+3H2����Mg+2HCl==MgCl2+H2����
������þ�����ʵ����ֱ���xmol��ymol���� ��
��![]() �����ԸúϽ����������ʵ�����0.06 mol�����ݵ���غ㣬n(Cl-)= 3n(Al 3+)+ 2n(Mg2 +)=3��0.06 mol+2��0.06 mol=0.3mol�����ʵ�����Cl-�����ʵ���Ũ����0.3mol��0.1L=3.0 mol��L-1��
�����ԸúϽ����������ʵ�����0.06 mol�����ݵ���غ㣬n(Cl-)= 3n(Al 3+)+ 2n(Mg2 +)=3��0.06 mol+2��0.06 mol=0.3mol�����ʵ�����Cl-�����ʵ���Ũ����0.3mol��0.1L=3.0 mol��L-1��

����Ŀ��2009��10��1�գ��ҹ��ɹ��ٰ������ʮ���ı���������ı���ʽ��9���綯�����϶�����������Դ���������࣬չʾ���ۺϹ����������Ƽ���չˮƽ��ͬʱҲ˵����Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ�� CO(g) �� 2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ�� CO2(g) �� 3H2(g)![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ������ԭ�Ӿ�����ԭ����� _____����������������������
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H1 0 ������������������������������
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ �����ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H3����44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
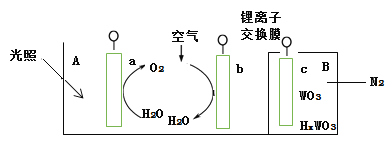
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ����
�������ͼ��ʾ�ĵ��װ�á��õ�������ĵ缫��ӦΪ ��

�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��