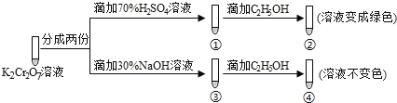
题目内容
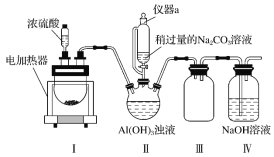
【题目】冰晶石又名六氟铝酸钠(Na3AlF6),白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na3AlF6的装置图如图(该装置均由聚四氟乙烯仪器组装而成)。
已知:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑
(1)装置Ⅲ的作用为__。
(2)在实验过程中,装置Ⅱ中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子方程式:__。
(3)在实验过程中,先向装置Ⅱ中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和Al(OH)3混合后再通入HF气体,其原因是__。
(4)装置Ⅱ反应后的混合液经过过滤可得到Na3AlF6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是__。
(5)萤石中含有少量的Fe2O3杂质,可用装置Ⅰ反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0g萤石加入装置Ⅰ中,完全反应后,将混合液加水稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当出现__现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为__。(已知:I2+2![]() =
=![]() +2I-)
+2I-)
【答案】作为安全瓶,防止倒吸 2Al(OH)3+12HF+6Na++3![]() =2NaAlF6↓+3CO2↑+9H2O 碳酸钠溶液呈碱性,Na2CO3会首先与HF反应,不利于Al(OH)3的溶解 取最后一次洗涤液少许于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,说明沉淀已洗涤干净 溶液蓝色褪去,且半分钟内不恢复 96%
=2NaAlF6↓+3CO2↑+9H2O 碳酸钠溶液呈碱性,Na2CO3会首先与HF反应,不利于Al(OH)3的溶解 取最后一次洗涤液少许于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,说明沉淀已洗涤干净 溶液蓝色褪去,且半分钟内不恢复 96%
【解析】
该制备实验原理是利用I装置中浓硫酸与CaF2反应制备HF,将生成物HF进入II装置中,向II装置中滴加Na2CO3溶液,利用II装置中物质之间反应制备Na3AlF6,III装置用作安全瓶防倒吸,因HF具有污染性,不能直接排放,因此利用IV装置吸收未完全反应的HF,据此实验原理解答。
(1)HF气体与NaOH反应较快,需要防倒吸,所以装置III的作用作为安全瓶,防止倒吸,故答案为:作为安全瓶,防止倒吸;
(2)装置II中析出的白色固体为Na3AlF6,又有CO2气体逸出,根据原子守恒以及电荷守恒可知反应的离子方程式为:2Al(OH)3+12HF+6Na++3![]() =2NaAlF6↓+3CO2↑+9H2O,故答案为:2Al(OH)3+12HF+6Na++3
=2NaAlF6↓+3CO2↑+9H2O,故答案为:2Al(OH)3+12HF+6Na++3![]() =2NaAlF6↓+3CO2↑+9H2O;
=2NaAlF6↓+3CO2↑+9H2O;
(3)若先将HF气体通入Na2CO3和A1(OH)3混合物中,碳酸钠溶液呈碱性,会首先与HF反应,不利于Al(OH)3的溶解,故答案为:碳酸钠溶液呈碱性,Na2CO3会首先与HF反应,不利于Al(OH)3的溶解;
(4)制备Na3AlF6的过程中,Na2CO3溶液是过量的,可检验最后一次洗涤液是否含有![]() ,所以所用试剂为BaCl2溶液,即取最后一次洗涤液少许于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,说明沉淀已洗涤干净,故答案为:取最后一次洗涤液少许于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,说明沉淀已洗涤干净;
,所以所用试剂为BaCl2溶液,即取最后一次洗涤液少许于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,说明沉淀已洗涤干净,故答案为:取最后一次洗涤液少许于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,说明沉淀已洗涤干净;
(5)Fe2O3与硫酸反应生成Fe3+,Fe3+氧化I生成I2,此时溶液呈蓝色,加入Na2S2O3溶液,I2被还原,溶液变成无色;利用守恒建立关系式:由Fe2O32Fe3+2Fe2+2e和![]() 有Fe2O32
有Fe2O32![]() ,n(Fe2O3)=
,n(Fe2O3)=![]() ,m(Fe2O3)=nM=0.002mol×160g/mol=0.32g;萤石中氟化钙的百分含量
,m(Fe2O3)=nM=0.002mol×160g/mol=0.32g;萤石中氟化钙的百分含量![]() ,故答案为:溶液蓝色褪去,且半分钟内不恢复;96%。
,故答案为:溶液蓝色褪去,且半分钟内不恢复;96%。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】“绿水青山就是金山银山”,研究NOx、SO2等大气污染物的妥善处理具有重要意义。
CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气。
有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
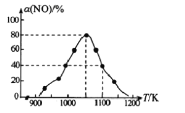
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为______________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数________(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =________(计算结果用分数表示)
=________(计算结果用分数表示)
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
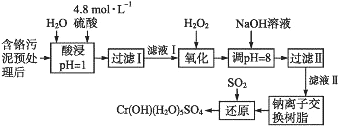
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的ph | 2.7 | — | — | — |
沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______;但溶液的pH不能超过8,其理由是________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________。