题目内容
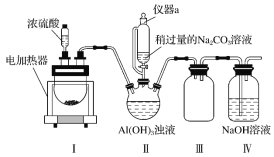
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
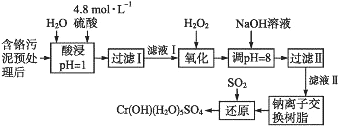
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的ph | 2.7 | — | — | — |
沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______;但溶液的pH不能超过8,其理由是________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________。
【答案】65 .2 250 mL容量瓶、胶头滴管 升高温度(加热)、搅拌 2Cr3++3H2O2+H2O===Cr2O72-+8H+ Na+、Ca2+、Mg2+ pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(Ⅲ)回收与再利用 Ca2+、Mg2+ 3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH
【解析】
(1)设需要浓硫酸的体积为VmL,则18.4mol·L-1×VmL=250mL×4.8mol·L-1,解得V=65.2;配制一定物质的量浓度的溶液需要的玻璃仪器有玻璃棒、烧杯、容量瓶、胶头滴管,所以还需要250 mL容量瓶、胶头滴管;
(2)为了提高浸取率,可以升高温度(加热)、搅拌等;
(3)H2O2具有强氧化性,能将Cr3+氧化为Cr2O72-,H2O2中O元素化合价降低为-2价,Cr元素化合价升高为+6价,根据氧化还原反应中化合价升降守恒以及电荷、原子守恒可写出其离子方程式为:2Cr3++3H2O2+H2O===Cr2O72-+8H+;
(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+,加入双氧水氧化Cr3+为Cr2O72-,加入NaOH溶液调节溶液pH,使溶液呈碱性,Cr2O72-转化为CrO4-;溶液pH=8,Fe3+、Al3+沉淀完全,滤液II中阳离子主要是Na+、Ca2+和Mg2+;pH>8时,氢氧化铝会溶解于强碱溶液中,影响铬离子的回收利用;
(5)滤液II中阳离子主要是Na+、Ca2+和Mg2+,故钠离子交换树脂交换的离子是钙离子和镁离子;
(6)二氧化硫具有还原性,被Na2CrO4氧化为SO42-,Na2CrO4被还原为CrOH(H2O)5SO4,根据原子守恒以及得失电子守恒写出反应的方程式为:3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH。

【题目】某矿石的主要成分是BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用该矿石制备BaCl2·2H2O的流程如图:
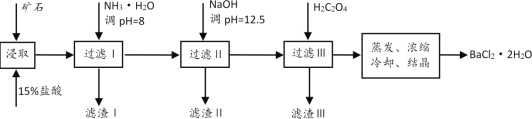
(1)用稀盐酸浸取前需充分研磨矿石,目的是__。
(2)加入NH3·H2O调节pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)要使Ca2+完全沉淀,应控制溶液中的![]() 的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
(4)利用氧化还原滴定法可测定H2C2O4的浓度,取20.00mLH2C2O4溶液于锥形瓶中,用0.10mol/L酸性KMnO4溶液滴定,KMnO4溶液应装在__(填“酸式滴定管”或“碱式滴定管”)中。写出反应的离子方程式为__。滴定终点的现象为__。若滴定达到终点时,消耗KMnO4溶液30.00mL,则H2C2O4溶液的浓度为__mol/L。
【题目】下列实验的操作、现象和结论均正确的是
实验操作 | 实验现象 | 实验结论, | |
A | 向FeCl3和 KSCN的混合溶液中滴加NaOH溶液 | 混合溶液颜色逐渐变浅,有红褐色沉淀产生 | Fe3+与SCN-生成Fe(SCN)3是可逆反应 |
B | 将密封有红棕色NO2气体的圆底烧瓶浸入冰水中 | 气体颜色变浅 | 反应2NO2 |
C | 分别向0.1 mol·L- 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液 | 醋酸溶液中有气泡产生,硼酸溶液中无气泡 | 酸性:硼酸>醋酸>碳酸 |
D | 将0.1 mol·L-1AgNO3溶液和0.05mol·L-1NaCl溶液等体积混合,再向混合液中滴入0.05 mol·L-1NaI溶液 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D