题目内容
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
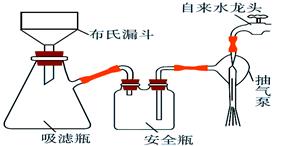
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。
(3)使用高锰酸钾法(一种氧化还原反应滴定法)可以测定所得产品的纯度。若需配制浓度为0.03000 mol·L-1KMnO4标准溶液240mL,应准确称取 g KMnO4(保留四位有效数字,已知M KMnO4=158.0g.mol-1)。配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有 。配制过程中,俯视刻度线定容则导致所配溶液浓度 (填“偏大”、“偏小”或“无影响”)。
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式 。
②判断到达滴定终点的现象是 。
③该产品的纯度为 ﹪(保留四位有效数字)。
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。

| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式 。
②判断到达滴定终点的现象是 。
③该产品的纯度为 ﹪(保留四位有效数字)。
(1)除去铁屑表面的油污(1分) 倾析法(1分)
(2)AD(2分) (3)1.185(2分) 250mL容量瓶、胶头滴管(2分) 偏大(1分)
(4)①2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑ + 8H2O (2分)
②加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化(1分) ③24.55 (2分)
(2)AD(2分) (3)1.185(2分) 250mL容量瓶、胶头滴管(2分) 偏大(1分)
(4)①2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑ + 8H2O (2分)
②加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化(1分) ③24.55 (2分)
试题分析:(1)碳酸钠是强碱弱酸盐,溶液显碱性,所以使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟的目的是除去铁屑表面的油污;由于铁是金属,不溶于水,所以可以使用倾析法分离并洗涤铁屑。
(2)A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸,滤纸大时,滤纸边缘与漏斗产生缝隙,使过滤速度慢,沉淀抽不干,滤纸小时,滤纸不能盖住所有孔,不能过滤,故A正确;B.放入滤纸后,用玻璃棒引流来转移溶液和沉淀,再打开水龙头抽滤,故B错误;C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再微接水龙头,将洗涤液慢慢透过全部晶体,故C错误;D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸,故D正确,答案选AD。
(3)由于没有240ml容量瓶,所以应该配制250ml高锰酸钾溶液,则需要高锰酸钾的质量是0.03000 mol·L-1×0.25L×158g/mol=1.185g;配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有250mL容量瓶、胶头滴管;配制过程中,俯视刻度线定容则导致容量瓶中溶液的体积偏少,因此所配溶液浓度偏大。
(4)①反应中碳元素的化合价从+3价升高到+4价失去1个电子,而Mn元素的化合价从+7价降低到+2价得到5个电子,因此根据电子得失守恒可知氧化剂与还原剂的物质的量之比是2:5,则根据原子守恒可知,配平后的方程式为5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O。
②由于酸性高锰酸钾溶液显紫红色,所以判断到达滴定终点的现象是加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化。
③根据方程式可知,参加反应的草酸根的物质的量是0.03000 mol·L-1×0.01L×
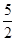 =0.0007500mol,所以2.000g样品中K3[Fe(C2O4)3]·3H2O的质量是0.0007500mol×
=0.0007500mol,所以2.000g样品中K3[Fe(C2O4)3]·3H2O的质量是0.0007500mol×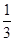 ×491/mol×
×491/mol× =0.491g,所以纯度为
=0.491g,所以纯度为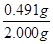 ×100%=24.55%。
×100%=24.55%。
练习册系列答案
相关题目
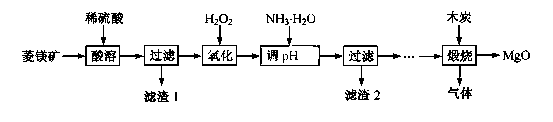
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑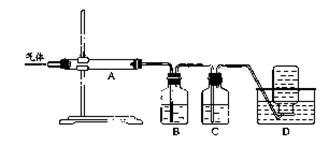
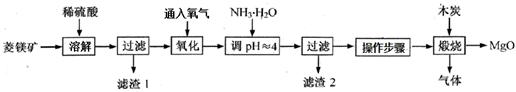
 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。