题目内容
下列除杂或鉴别的实验方法中不正确的是( )
| A.除去NaCl溶液中少量CaCl2:加入适量Na2CO3,过滤 |
| B.用酒精可以从碘水中萃取碘 |
| C.Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 |
| D.用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2 |
B
试题分析:A、除去NaCl溶液中少量CaCl2:加入适量Na2CO3,钙离子与碳酸根反应生成碳酸钙沉淀,过滤除去,正确;B、萃取剂不能溶于水,酒精可与水互溶,不用酒精可以从碘水中萃取碘,错误;C、碳酸氢钠受分解生成碳酸钠、二氧化碳和水,碳酸钠受热不分解,Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯,正确;D、二氧化硫具有漂白性和氧化性,可分别使品红溶液、酸性KMnO4溶液褪色,而二氧化碳不能,可用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2,正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
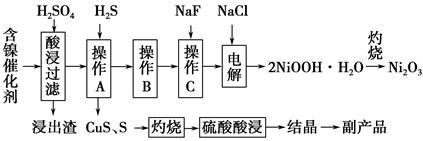
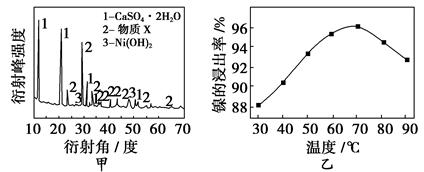
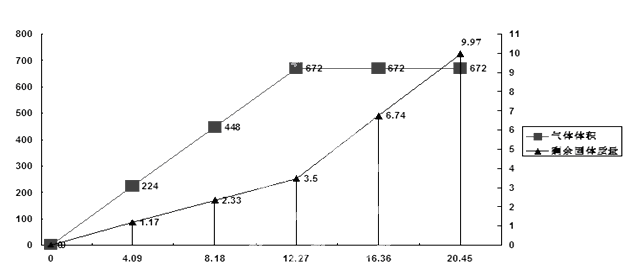


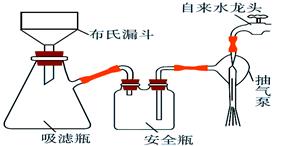
 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线: CH2+CO+H2
CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO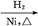 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;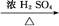 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。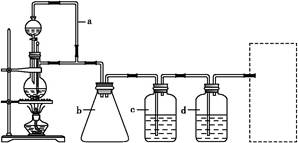
 RCH(OH)SO3Na↓;②沸点:乙醚34℃,1
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1 滤液
滤液
 有机层
有机层 1
1 纯品
纯品