题目内容
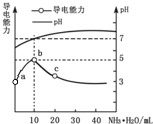
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
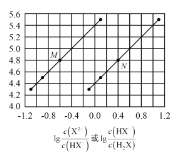
A.Ka2(H2X)的数量级为10-5
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)<c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)>c(H+)
【答案】B
【解析】
在横坐标为0.0时,由曲线M对应的pH大于曲线N对应的pH,由于己二酸的一级电离远大于二级电离,则曲线M表示pH与lg![]() 的变化关系,曲线N表示pH与lg
的变化关系,曲线N表示pH与lg![]() 的变化关系;
的变化关系;
A. Ka2(H2X)=![]() ·c(H+),当横坐标为0.0时曲线M的纵坐标为5.4,即pH=5.4,此时c(X2-)=c(HX-),则Ka2=10-5.4,数量级为10-6,A项错误;
·c(H+),当横坐标为0.0时曲线M的纵坐标为5.4,即pH=5.4,此时c(X2-)=c(HX-),则Ka2=10-5.4,数量级为10-6,A项错误;
B. 在横坐标为0.0时,由曲线M对应的pH大于曲线N对应的pH,由于己二酸的一级电离远大于二级电离,则曲线M表示pH与lg![]() 的变化关系,曲线N表示pH与lg
的变化关系,曲线N表示pH与lg![]() 的变化关系,故B项正确;
的变化关系,故B项正确;
C.根据图像可知,当横坐标为0.0时曲线N的纵坐标为4.4,即pH=4.4,此时c(HX-)=c(H2X),则Ka1=10-4.4,则HX-的水解平衡常数Kh=![]() =
=![]() =
=![]() =10-9.6<Ka2,HX-的电离程度大于其水解程度,溶液呈酸性,则c(H+)>c(OH-),C项错误;
=10-9.6<Ka2,HX-的电离程度大于其水解程度,溶液呈酸性,则c(H+)>c(OH-),C项错误;
D. 由图像可知当pH等于7时,lg![]() >0,即c(X2-)>c(HX-),D项错误;
>0,即c(X2-)>c(HX-),D项错误;
故答案选B。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】(I)![]() 和
和 的一些物理性质如下表:
的一些物理性质如下表:
物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
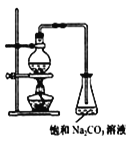
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h