题目内容
有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1mol?L﹣1的盐酸的体积为( )
| A.0.05 L | B.0.1 L | C.0.2 L | D.1 L |
B
解析试题分析:根据电荷守恒的思路,可以认为混合物与盐酸反应是把混合物中的氧元素等价变成氯元素(化合价不变),混合物被氢气还原后减轻的质量即是氧元素的质量。故n(Cl)=2n(O)=0.8÷16×2=0.1mol,所以盐酸的体积为 0.1 L。
考点:考查元素化合物的基本计算。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
化学用语是学习化学的重要工具,下列化学用语中,正确的是
| A.硫酸与氢氧化钡中和:H+ + OH- = H2O |
B.碳酸氢钠的水解:HCO3-+ H2O 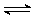 H3O++ CO32- H3O++ CO32- |
C.碳酸钠的水解:CO32-+2H2O  H2O+ CO2+2OH- H2O+ CO2+2OH- |
| D.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓+ 3 NH4+ |
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含bmolBaCl2的溶液恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
A.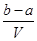 mol·Lˉ1 mol·Lˉ1 | B.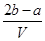 mol·Lˉ1 mol·Lˉ1 |
C. mol·Lˉ1 mol·Lˉ1 | D.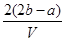 mol·Lˉ1 mol·Lˉ1 |
以NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.标准状况下,22.4L的H2和CO2混合气体中含有的分子总数为NA |
| B.常温常压下,24g金属镁变为镁离子时得到的电子数为2NA |
| C.标准状况下,5.6L水含有的分子数为0.25NA |
| D.1 mol Cl2与足量Fe反应,转移的电子数为3NA |
下列化学用语正确的是
A.聚丙烯的结构简式: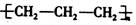 |
B.丙烷分子的比例模型: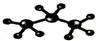 |
C.四氯化碳分子的电子式: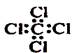 |
| D.甲烷结构简式为CH4 |
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是( )
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物总质量为14.4 g |
| C.反应后的固体混合物中单质Cu的质量为12.8 g |
| D.反应后的固体混合物中氧化物的物质的量为0.05 mol |
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.次氯酸的电子式: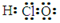 |
B.质量数为16的氧原子: |
C.乙烯的结构简式: |
D.碳酸氢根离子的电离方程式: HCO3-+ H2O H3O++ CO32- H3O++ CO32- |
下列化学用语正确的是
A.硫离子的结构示意图: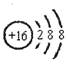 |
B.氟化镁的电子式: |
| C.甘氨酸的结构式:C2H5O2N |
| D.氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH)22- |