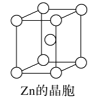
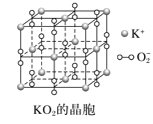
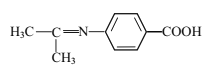
题目内容
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.5. 6 L由CO2和O2组成的混合气体中的分子数为0. 25NA
B.5. 6 g铁与足量的稀硫酸完全反应转移的电子数为0. 2NA
C.0. 5 mol L-1的BaCl2溶液中含有Cl-的数目为NA
D.10 g质量分数为17%的H2O2溶液中含氧原子的数目为0. 1NA
【答案】B
【解析】
A.没有给标况,不能准确计算混合气体的物质的量,A错误;
B.由 解得:n=0.2mol,即5. 6 g铁与足量的稀硫酸完全反应转移的电子数为0. 2NA,B正确;
解得:n=0.2mol,即5. 6 g铁与足量的稀硫酸完全反应转移的电子数为0. 2NA,B正确;
C.n=cV,只给了浓度c,没给体积V,不能计算,C错误;
D.H2O2的质量m=10 g×17%=1.7g,n(H2O2)=![]() =0.1mol,H2O2中n(O)=0.2mol,溶液中的水也含O,所以10 g质量分数为17%的H2O2溶液中含氧原子的数目大于0.2NA,D错误。
=0.1mol,H2O2中n(O)=0.2mol,溶液中的水也含O,所以10 g质量分数为17%的H2O2溶液中含氧原子的数目大于0.2NA,D错误。
答案选B。

【题目】某 500 mL 溶液中只可能含有 Na+、NH4+、Mg2+、Al3+、Fe2+、Fe3+、Cl-、![]() 、
、![]() 中 的几种离子。
中 的几种离子。
已知:NH4++OH-=NH3↑ +H2O
(1)取该溶液l00 mL,逐滴加入足量的NaOH溶液并加热,生成标准状况下的气体体积为 896 mL(气体已全部逸出),滴加过程中无沉淀生成。则该溶液中一定不含有的阳离子是______.
(2)另取100 mL原溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀6.27 g,再加入足量稀盐酸,沉淀部分溶解,生成标准状况下的气体体积为448 mL。则原浓液中下列离子的浓度:
离子种类 | 离子浓度 |
| ①___molL-1 |
| ②___ molL-1 |
Na+ | ③__molL-1 |
写出加入盐酸时,生成气体的离子方程式:__________。
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ