题目内容
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为________。
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):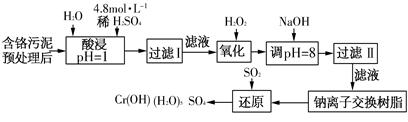
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是________(填Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O = □Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①________;②________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
(15分)
(一)2Al+OH-+NO2-+2H2O===2AlO2-+NH3·H2O
(二)(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可)
(2)Fe3+、Al3+ (3)Mg2+、Ca2+ (4)1 3 11 2 1 1.5mol
(三)①通入足量氯气将Fe2+氧化成Fe3+ ②加入CuO调节溶液的pH至3.2~4.7
解析试题分析:(一) 加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体,说明氮的还原产物为NH3, 除去NO2-的离子方程式为:2Al+OH-+NO2-+2H2O===2AlO2-+NH3·H2O,答案为:2Al+OH-+NO2-+2H2O===2AlO2-+NH3·H2O;
(二)(1) 酸浸时,为了提高浸取率可采取的措施可以从温度、浓度、时间、改变反应物粒子大小等角度去答。答案为:升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可);
⑵从表中看出,pH小于8时Fe3+(3.2)、Al3+(8)均沉淀完全,答案:Fe3+、Al3+;
⑶Fe3+、Al3+已经沉淀,溶液中还有Ca2+、Mg2+,用离子交换树脂除去,答案:Ca2+、Mg2+;
⑷用化合价升降法或电子守恒配平方程式: 1 Na2Cr2O7+ 3 SO2+ 11 H2O = 2 Cr(OH)(H2O)5SO4+ 1 Na2SO4,由方程式每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为1.5mol,答案:1 3 11 2 1 1.5mol
(三)Fe2+ 在PH=9.0时才沉淀完全,而此时Cu2+ 已经沉淀,所以要能Cl2将Fe2+ 氧化成Fe3+ ,然后加CuO或Cu (OH)2或Cu2(OH)2CO3调节PH至3.2~4.7。答案:①通入足量氯气将Fe2+氧化成Fe3+ ②加入CuO调节溶液的pH至3.2~4.7。
考点:氧化还原反应的配平、化学速率、Fe3+ 等常见离子的性质和除杂等基础知识,中等难度。

 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。 HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。