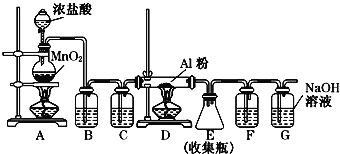
题目内容
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是
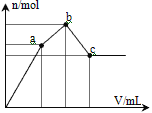
A. a点对应的沉淀只有BaSO4
B. b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-==Al(OH)3↓+2BaSO4↓
C. c点溶液呈碱性
D. c点加入Ba(OH)2溶液的体积为200 mL
【答案】C
【解析】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液,硫酸根结合钡离子生成硫酸钡沉淀,铵根和铝离子结合氢氧根生成一水合氨和氢氧化铝沉淀,氢氧化钡过量时氢氧化铝被氢氧根溶解生成偏铝酸盐,结合图像变化趋势、有关离子的物质的量分析解答。
NH4Al(SO4)2物质的量为0.01mol,溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol。开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液。则
A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点对应的沉淀为BaSO4和Al(OH)3,A错误;
B、由分析可知,b点发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3H2O,B错误;
C、由分析可知,c点溶液为氨水与偏铝酸钡溶液,所以溶液呈碱性,C正确;
D、由分析可知,c点加入Ba(OH)2的物质的量为0.005mol+0.02mol=0.025mol,所以需要氢氧化钡溶液的体积为0.025mol÷0.1mol/L=0.25L=250mL,D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案