题目内容
【题目】(1)用甲烷—空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:
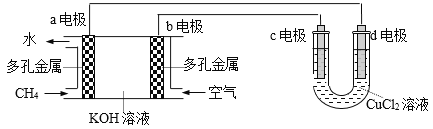
①a电极名称为_______。
②c电极的电极反应式为_________________。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是_______L(空气中O2体积分数约为20%)。
(2)在一定条件下,恒温恒容密闭容器中进行可逆反应:N2+3H2![]() 2NH3。
2NH3。
①试判断下列情况能说明该反应已经达到化学平衡状态的是________________(填字母序号)。
a.单位时间内生成n mol N2同时生成3n mol H2
b.H2的生成速率等于NH3的生成速率
c.一个N≡N键断裂的同时,有三个H—H键形成
d.容器中N2、H2、NH3的浓度之比为1∶3∶2
e.反应物浓度等于生成物浓度
f.混合气体的总物质的量不变
②298 K时,若已知生成标准状况下2.24 L NH3时放出热量为4.62 kJ。写出合成氨反应的热化学方程式_____________________。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4 kJ,其原因是_______________________。
(3)某课外活动小组用下图装置进行实验,试回答:

①若开始时K接M,则铁极上的电极反应式为______,石墨极上的电极反应式为________。
②若开始时K接N,则石墨极上的电极反应式为______,电解的总化学方程式为_______。
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
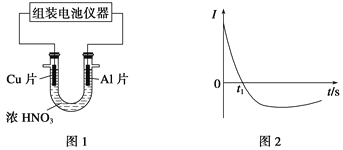
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是________,溶液中的H+向_____极移动。t1时,原电池中电子流动方向发生改变,其原因是____________________________。
【答案】 负极 2Cl--2e-=Cl2↑ 2.8 cf N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1 合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3 Fe-2e-=Fe2+ O2+2H2O+4e-=4OH- 2Cl--2e-=Cl2↑ 2NaCl+2H2O
2NH3(g) ΔH=-92.4 kJ·mol-1 合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3 Fe-2e-=Fe2+ O2+2H2O+4e-=4OH- 2Cl--2e-=Cl2↑ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2H++NO
2NaOH+H2↑+Cl2↑ 2H++NO![]() +e-=NO2↑+H2O 正 随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜作负极发生氧化反应,电流方向与原来相反
+e-=NO2↑+H2O 正 随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜作负极发生氧化反应,电流方向与原来相反
【解析】(1)①a电极通入甲烷,是负极。②c电极与电源的正极相连,作阳极,电极反应式为2Cl--2e-=Cl2↑。③3.2 g 金属Cu是0.05mol,转移0.1mol电子,根据电子得失守恒可知消耗氧气是0.025mol,标准状况下的体积是0.025mol×22.4L/mol=0.56L,因此理论上燃料电池消耗的空气在标准状况下的体积是0.56L÷0.2=2.8L。
(2)①a.单位时间内生成n mol N2同时生成3n mol H2,均表示逆反应速率,不能说明反应达到平衡状态,a错误;b.H2的生成速率等于NH3的生成速率不满足反应速率之比是相应的化学计量数之比,没有达到平衡状态,b错误;c.一个N≡N键断裂的同时,有三个H—H键形成表示正逆反应速率相等,达到平衡状态,c正确;d.容器中N2、H2、NH3的浓度之比为1∶3∶2不能说明正逆反应速率相等,因此不一定处于平衡状态,d错误;e.反应物浓度等于生成物浓度不能说明正逆反应速率相等,因此不一定处于平衡状态,e错误;f.正反应是体积减小的,则混合气体的总物质的量不变说明正逆反应速率相等,处于平衡状态,f正确,答案选cf;②标准状况下2.24 L NH3是0.1mol,则生成2mol氨气放热是92.4 kJ,所以合成氨反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。由于合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3,因此测得反应放出的热量总小于92.4 kJ;(3)①若开始时K接M构成原电池,铁是负极,则铁极上的电极反应式为Fe-2e-=Fe2+,石墨极是正极,溶液中的氧气得到电子,电极反应式为O2+2H2O+4e-=4OH-。②若开始时K接N构成电解池,石墨与电源正极相连,作阳极,则石墨极上的电极反应式为2Cl--2e-=Cl2↑,阴极是氢离子放电,则电解的总化学方程式为2NaCl+2H2O
2NH3(g) ΔH=-92.4 kJ·mol-1。由于合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3,因此测得反应放出的热量总小于92.4 kJ;(3)①若开始时K接M构成原电池,铁是负极,则铁极上的电极反应式为Fe-2e-=Fe2+,石墨极是正极,溶液中的氧气得到电子,电极反应式为O2+2H2O+4e-=4OH-。②若开始时K接N构成电解池,石墨与电源正极相连,作阳极,则石墨极上的电极反应式为2Cl--2e-=Cl2↑,阴极是氢离子放电,则电解的总化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(4)0~t1时,原电池的负极是Al片,此时正极是硝酸根得到电子,电极反应式是2H++NO3-+e-=NO2↑+H2O;原电池中阳离子向正极移动,则溶液中的H+向正极移动。由于随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜作负极发生氧化反应,电流方向与原来相反,因此原电池中电子流动方向发生改变。


