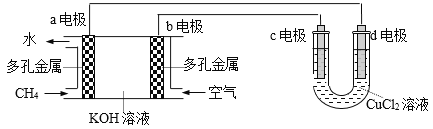
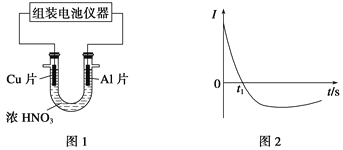
题目内容
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。
CH3OH(g)+H2O(g) △H<0。
可认定该可逆反应在一定条件下已达到化学平衡状态的是
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B.v正(CO2)=v逆(H2O)
C.容器内混合气体密度保持不变
D.3molH-H键断裂同时断裂3molH-O键
【答案】B
【解析】
试题分析:A.容器中CO2、H2、CH3OH、H2O的物质的量之比也可能为1:3:1:1,该反应可能达到平衡状态,也可能没有达到平衡状态,与反应初始浓度和转化率有关,A错误;B.v正(CO2)=v逆(H2O),方向相反,化学反应速率之比与计量数成正比,能判断平衡状态,B正确;C.CO2(g)+3H2(g)CH3OH(g)+H2O(g)反应中,前后气体质量不变,固定容积,体积不变,故密度不是变量,不能判断化学平衡状态,C错误;D.3molH-H键断裂同时,应该断裂2molH-O键,才能说明化学达到平衡状态,当3molH-H键断裂同时,断裂3molH-O键时不能据此判断化学平衡状态,D错误;故选B.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ⑥ | ④ | ⑤ | ⑦ | ⑩ | ⑧ | ⑨ |
⑴在这10种元素中,非金属性最强的元素是_____ (填“元素符号”);金属性最强的元素是_____(填“元素符号”);化学性质最不活泼的元素是_______(填“元素符号”);元素②简单离子的结构示意图为___________________。
⑵元素①与②中,原子半径较大的是________(填元素符号)。
⑶元素②与⑦的气态氢化物分别为__________和__________ (填化学式),两者的热稳定性大小为:前者_____后者。(填“>”、“<”或“=”)。
⑷元素④与⑧的最高价氧化物的水化物分别为______和______(填“化学式”),
两者反应的离子方程式为__________________________________。
⑸元素⑤的氧化物与盐酸反应的离子方程式为: _______________________。
⑹元素⑧的单质与元素⑩的氢化物反应的化学方程式为:__________________。