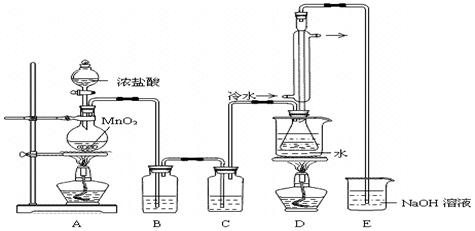
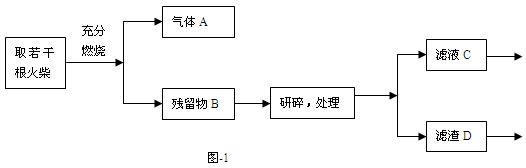
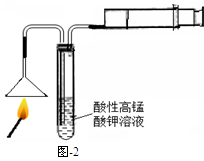
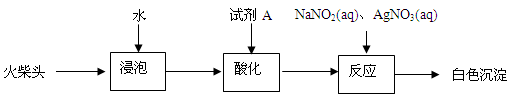
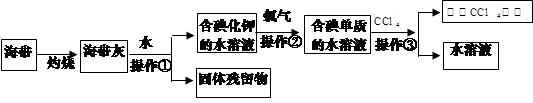题目内容
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
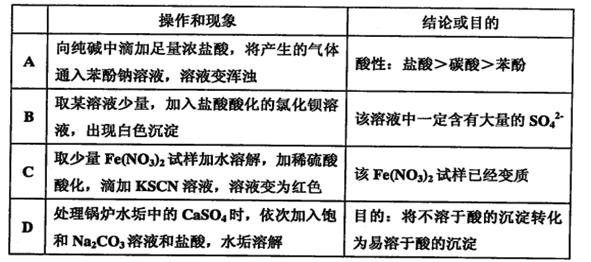
| | 操作 | 现象 | 结论 |
| A | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A
试题分析:A、I2易溶于CCl4且溶液显紫色;B、若溶液中含有SO32-也可以被HNO3氧化为SO42-而产生白色沉淀;C、未通过蓝色钴玻璃不能判断K+是否存在;D、NH3易溶于水,选用稀NaOH溶液不利于NH3的放出。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
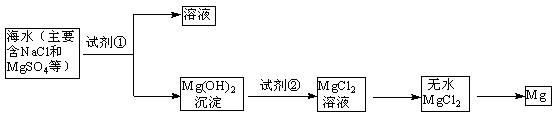





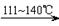 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2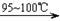 S2Cl2。
S2Cl2。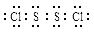 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: