题目内容
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。

①据此判断该反应的正反应为____(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
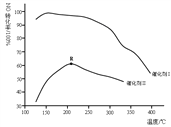
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
【答案】CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-977.2kJ/mol 放热 80 648 4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O 温度太高,会降低催化剂活性 低于925℃反应速率较慢,高于925℃不利于脱硝反应正向进行
4CO2+7N2+8H2O 温度太高,会降低催化剂活性 低于925℃反应速率较慢,高于925℃不利于脱硝反应正向进行
【解析】
(1) CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②2N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
利用盖斯定律计算①+②-③×2得到CH4催化还原NO的热化学方程式;
(2)①根据先拐先平温度高,T1>T2,纵轴温度越高CO浓度越大,说明升温平衡逆向进行;
②温度为T1时,化学平衡常数的的含义,利用三段式计算出各种物质的平衡浓度,将各种物质的平衡浓度带入公式可得其平衡常数的数值;速率常数只与温度有关,温度不变,速率常数不变,根据平衡时v正= v逆,可得![]() =K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),代入
=K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),代入![]() 即可计算出其数值;
即可计算出其数值;
(3)①尿素[CO(NH2)2]作还原剂还原NO2,反应生成氮气、二氧化碳和水;
②脱硝的最佳温度约为925℃,此时脱硝效率最大,SNCR与SCR技术相比,SNCR技术的反应温度较高是因为未加入催化剂,从催化剂活性分析温度的影响;从平衡移动角度及反应速率选择合适的温度。
(1)①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②2N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
利用盖斯定律计算①+②-③×2得到CH4催化还原NO的热化学方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -977.2 kJ/mol;
(2)①先拐先平温度高,T1>T2,纵轴温度越高CO浓度越大,说明升温平衡逆向进行,则该反应的正反应为放热反应,△H<0;
②在某密闭容器中通入等量的CO和NO,根据图象可知开始时,c(CO)=c(NO)= 2mol/L,平衡状态下一氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1.6 1.6 1 .6 0.8
平衡量(mol/L) 0.4 0.4 1.6 0.8
根据平衡常数的含义可得该温度下的反应平衡常数K=![]() =80;
=80;
当该可逆反应达到平衡时v正= v逆,根据v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),可得![]() =K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),在a点,c(NO)=c(CO)=1.2mol/L,根据物质反应时的物质的量关系可知,此时c(CO2)=0.8mol/L,c(N2)= 0.4mol/L,则
=K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),在a点,c(NO)=c(CO)=1.2mol/L,根据物质反应时的物质的量关系可知,此时c(CO2)=0.8mol/L,c(N2)= 0.4mol/L,则![]() =
=![]() =
=![]() =648;
=648;
(3)①尿素[CO(NH2)2]作还原剂还原NO2,反应生成氮气、二氧化碳和水,反应的化学方程式为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O;
4CO2+7N2+8H2O;
②图象可知SNCR技术的脱硝的最佳温度为:925°C左右,但温度也不能太高,这是因为温度低,反应速率慢,但温度太高, 会降低催化剂活性;当体系温度约为925℃C时,SNCR脱硝效率最高,其可能的原因是温度较低时,化学反应速率慢,达到平衡所需的时间过长,生产效率低下,温度过高,催化剂活性降低,且升高温度有利于反应向吸热的逆反应方向方向进行,不利于脱硝技术消除烟气中的氮氧化物。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案