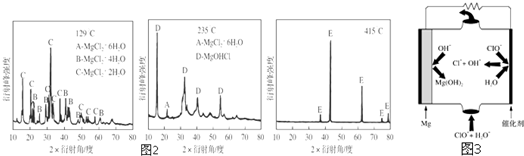
题目内容
7.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)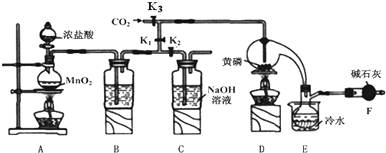
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(2)B中所装试剂是吸收多余的氯气,防止空气中的H2O进入烧瓶和PCl3反应
(3)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(4)F中碱石灰的作用是吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应
(5)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(6)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(7)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
分析 根据装置图可知工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余氯气,防止空气中的水蒸气进入烧瓶和PCl3反应;
(1)A装置中二氧化锰和浓盐酸反应制取氯气,据此书写离子反应方程式;
(2)B装置利用浓硫酸干燥氯气;
(3)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,据此书写离子反应方程式;
(4)碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;
(5)白磷能自燃,通入二氧化碳赶净空气;
(6)根据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷;
(7)根据反应的化学方程式H3PO3+H2O+I2=H3PO4+2HI、I2+2Na2S2O3=2NaI+Na2S4O6 可知n(H3PO3)=n(I2)总-n(Na2S2O3)×$\frac{1}{2}$,25mL溶液中H3PO3的物质的量等于PC13的物质的量,再求出PC13的总物质的量和质量,然后求出质量分数.
解答 解:(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)氯气中含有水蒸气,氯气为酸性气体,需用酸性干燥剂干燥,所以B中所装试剂是浓硫酸;
故答案为:浓硫酸;
(3)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+2H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+2H2O;
(4)氯气有毒,污染空气,碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度,
故答案为:吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(5)通入一段时间的CO2可以排尽装置中的空气,防止白磷与空气中的氧气发生自燃;
故答案为:排尽装置中的空气,防止白磷自燃;
(6)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离;
故答案为:蒸馏;
(7)0.1000mol/L碘溶液10.00mL中含有碘单质的物质的量为:0.1000mol/L×0.0100L=0.00100mol,根据反应I2+2Na2S2O3=2NaI+Na2S4O6可知,与磷酸反应消耗的碘单质的物质的量为:0.00100mol-0.1000mol/L×0.00084L×$\frac{1}{2}$=0.00058mol,再由H3PO3+H2O+I2=H3PO4+2HI可知,25mLPC13水解后的溶液中含有的H3PO3的物质的量为:n(H3PO3)=n(I2)=0.00058mol,250mL该溶液中含有H3PO3的物质的量为:0.00058mol×$\frac{250mL}{25mL}$=0.0058mol,所以1.00g产品中含有的PC13的物质的量为0.0058mol,该产品中PCl3的质量分数为:$\frac{137.5g/mol×0.0058mol}{1g}$×100%=79.75%;
故答案为:79.75%.
点评 本题主要考查学生阅读获取信息的能力、对实验原理理解等,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,题目难度较大.

下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写可能正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Na+、Fe3+、Cl-、I- | NaOH溶液 | Fe3++3OH-=Fe(OH)3↓ |
B | Mg2+、HCO | 过量NaOH溶液 | Mg2++HCO H2O+Mg(OH)2↓+CO |
C | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2=CO |
D | Na+、NO | NaHSO4溶液 | SO |
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是CD(填序号字母).
A.容器内压强保持不变 B. 2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
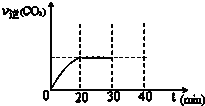
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是减小CO2 的浓度.请在图中画出30min至40min的变化曲线.
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 降低温度,正反应速率减小,而逆反应速率增大 | |
| C. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g | |
| D. | 达到平衡时,SO2的转化率是90% |
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Z和氢三种元素形成的化合物中只有共价键 | |
| C. | 原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Z) | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
 、Cl-
、Cl-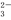
 、SO
、SO