题目内容
①14Cu2++5FeS2+12H2O = 7Cu2S + 5Fe2+ + 24H++3SO42-
②Mn2+ + S2O82- + H2O— MnO4- + SO42- H+
对上述两个反应判断正确的是:
| A.①②反应中SO42—都是氧化产物 |
| B.两个反应中电子转移数目都是10mol |
| C.①反应中的硫元素既被氧化又被还原 |
| D.氧化性:MnO4—> S2O82— |
C
解析试题分析:A、S2O82-中S元素为+6价,转化为SO42?S化合价不变,所以反应②中SO42?不是氧化产物,错误;B、反应①化合价升高的是FeS2中的S转化为SO42?,转移电子为3×7mol=21mol,错误;C、5FeS2中3S转化为SO42?,硫元素化合价升高,7S转化为Cu2S,硫元素化合价降低,所以①反应中的硫元素既被氧化又被还原,正确;D、反应②中,S2O82—为氧化剂,MnO4—为氧化产物,根据氧化剂的氧化性大于氧化产物,则氧化性: S2O82—>MnO4—,错误。
考点:本题考查氧化还原反应原理。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑ CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+=Ce3+ + 2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.铈的四种核素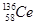 、 、 、 、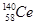 、 、 ,它们互称为同素异形体 ,它们互称为同素异形体 |
关于反应3Cl2 + 6KOH 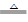 KClO3 + 5KCl + 3H2O,以下说法正确的是
KClO3 + 5KCl + 3H2O,以下说法正确的是
| A.KOH既不是氧化剂,又不是还原剂 |
| B.Cl2是氧化剂,KOH是还原剂 |
| C.3mol氯气参加反应转移6 mol电子 |
| D.被氧化的氯元素的质量为被还原的氯元素质量的5倍 |
下列变化中,属于还原反应的是
| A.Cl-→Cl2 | B.FeCl2→FeCl3 | C.C→CO2 | D.KMnO4→MnO2 |
将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4+28HNO3= 9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.稀HNO3在反应中只表现氧化性 |
| C.磁性氧化铁中的所有铁元素全部被氧化 |
| D.反应中每还原0.3mol氧化剂,就有0.9mol电子转移 |
已知在酸性溶液中的还原性强弱顺序为:SO2 >I–>H2O2>Fe2+>Cl–,下列反应不可能发生的是:
| A.H2O2+ H2SO4=SO2↑+ O2↑+2 H2O |
| B.2I– +2Fe3+=I2+2 Fe2+ |
| C.2Fe3++ SO2 +2H2O=2Fe2++SO42– +4H+ |
| D.SO2 +2 H2O+ I2=H2SO4+2HI |
从氧化还原角度分析,下列反应中水的作用相同的是 ( )
① Na和H2O ② NO2和H2O ③ Cl2和H2O ④ Na2O2和H2O
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:1lP+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应说法错误的是:
| A.生成1 mol H3PO4时,有5 mol电子转移 |
| B.5molCuSO4参加反应时,被氧化的P为1mol |
| C.氧化产物和还原产物的物质的量之比为6:5 |
| D.6molH3PO4生成时,被CuSO4氧化的P为3mol |
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是
| A.“另一种反应物”一定具有还原性 |
| B.CuH既可做氧化剂也可做还原剂 |
| C.CuH+Cl2=CuCl+HCl(燃烧) |
| D.CuH+HCl=CuCl+H2↑(常温) |