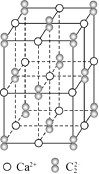
题目内容
【题目】已知25oC时,H2A的Ka1=10-1.85,Ka2=10-7.19。用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法不正确的是
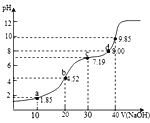
A.a点所得溶液中:2c(H2A)+c(A2-)<0.1mol·L-1
B.NaHA溶液中由水电离出的氢离子浓度小于1.0×10-7mol·L-1
C.c点所得溶液中:c(Na+)<3c(HA_)
D.d点所得溶液中:c(Na+)>c(A2-)>c(HA-)
【答案】C
【解析】
A.用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液, a点溶液中溶质为H2A和NaHA,由图可知pH= 1.85= pKa1,根据电离平衡常数表达式可知,c(H2A)= c(HA- ),溶液体积大于20ml,根据物料守恒 a点所得溶液中:c(H2A)+ c(A2-)+ c(HA-) = 2c(H2A)+c(A2- )<0.1mol/L,故A正确;
B.根据电离平衡常数, HA-的电离平衡常数为Ka2 =10-7.19,HA-的水解常数Kh=![]() =10-12.15,可见电离趋势大于水解趋势,所以抑制水的电离,则水电离出的氢离子浓度小于1.0×10-7mol·L-1,故B正确;
=10-12.15,可见电离趋势大于水解趋势,所以抑制水的电离,则水电离出的氢离子浓度小于1.0×10-7mol·L-1,故B正确;
C.c点pH= 7.19=pKa2,则c(A2-)=c(HA-),溶液显碱性,溶液中溶质为等物质的量浓度的Na2A、NaHA,根据物料守恒可知2c(Na+)=3[c(A2-)+c(HA-)+c(H2A)]=3[2c(HA-)+c(H2A)],所以c(Na+)>3c(HA-),故C错误;
D.加入氢氧化钠溶液40mL, NaOH溶液滴定20mL0.1mol/LH2A溶液恰好反应生成Na2A,溶液中离子浓度c(Na+)>c(A2-)>c(HA-),故D正确;
故答案:C。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
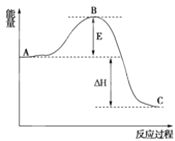
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)![]() C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。
C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。

化学键 | C=O | H—H | C=C | C—H | H—O |
键能/kJ·mol-1 | 803 | 436 | x | 414 | 464 |
(2)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
化学键 | N≡N | O | N—N | N—H | O—H |
946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式:___。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由CO2制取C的太阳能工艺如图所示。
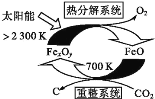
若“重整系统”发生的反应中![]() =6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
=6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) ΔH2=+23.4kJ·mol-1,则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
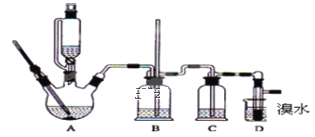
【题目】实验室用少量的溴水和足量的乙烯制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式:___________________________________。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞.请写出发生堵塞时瓶B中的现象:______________________________________________________。
(3)在装置C中应加入_____(填字母),(a.水 b.浓硫酸 c.氢氧化钠溶液)其目的是 ___________________________________________________________________。
(4)若产物中有少量副产物乙醚,可用 ________________ 的方法除去。
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 _________________________________________________________________________。