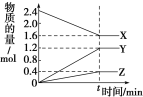
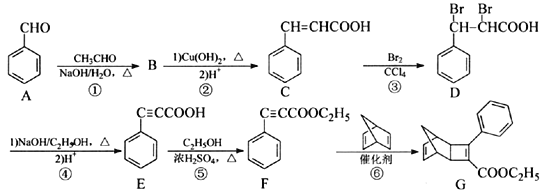
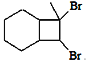
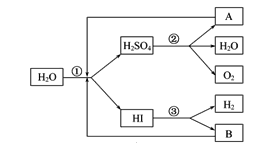
��Ŀ����
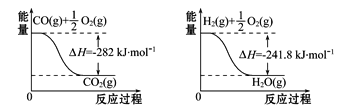
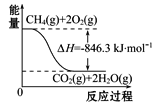
����Ŀ����֪�Ȼ�ѧ����ʽ:2SO2(g)+O2(g) ![]() 2SO3(g)����H=-Q kJ��mol-1(Q>0)������˵����ȷ����(����)
2SO3(g)����H=-Q kJ��mol-1(Q>0)������˵����ȷ����(����)
A. ��ͬ������,2 mol SO2(g)��1 mol O2(g)�����е�����С��2 mol SO3(g)�����е�����
B. ��2 mol SO2(g)��1 mol O2(g)����һ�ܱ������г�ַ�Ӧ��,�ų�������ΪQ kJ
C. ��ʹ�ô���,�÷�Ӧ��|��H|��С
D. �罫һ����SO2(g)��O2(g)����ij�ܱ������г�ַ�Ӧ�����Q kJ,��˹�������2 molSO2(g)������
���𰸡�D
��������
A��˷�Ӧ�Ƿ��ȷ�Ӧ������2 molSO2(g)��1 molO2(g)�����е���������2 mol SO3(g)�����е���������A����
B����ڸ÷�ӦΪ���淴Ӧ��������ȫ��Ӧ���ʽ�2 molSO2(g)��1molO2(g)����һ�ܱ������У��μӷ�Ӧ�� SO2(g)һ������2mol���ų�������һ��С��Q kJ����B����
C���ʹ�ô��������ͷ�Ӧ�Ļ�ܣ����Dz�Ӱ��ƽ���ƶ����÷�Ӧ��|��H|���䣬��C������
D��ɸ��Ȼ�ѧ����ʽ��֪������2 molSO2(g)�μӷ�Ӧ����2molSO2(g)������ʱ���ų�������ΪQ kJ����D��ȷ��
��������������ѡD��

��ϰ��ϵ�д�
�����Ŀ