题目内容
【题目】如下图设计的串联电池装置,R为变阻器,以调节电路电流。
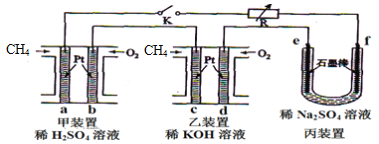
(1)写出b、c电极的电极反应式:b______________,c_______________;
(2)写出f电极的电极反应式____________________,向此电极区域滴入酚酞的现象为:_____________;该电极区域水的电离平衡被____________(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________(填“变大”、“变小”或“不变”),原因是______________。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______g H2O就可以将析出的沉淀溶解并恢复到原有浓度。
【答案】O2+4H++4e-=2H2OCH4+10OH--8e-=CO32-+7H2O2H++2e-=H2↑溶液变红促进不变硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变72
【解析】
根据图示,甲乙装置为两个燃料电池串联,丙为电解硫酸钠的装置。甲乙装置中通入甲烷的电极为负极,即a、c为负极,通入氧气的为正极,即b、d为正极,则e为阳极,f为阴极。
(1)根据上述分析,b为正极,发生还原反应,电解质为硫酸,电极反应式为O2+4H++4e-=2H2O,c电极为负极,发生氧化反应,电解质为氢氧化钾,电极反应式为CH4+10OH--8e-=CO32-+7H2O,故答案为:O2+4H++4e-=2H2O;CH4+10OH--8e-=CO32-+7H2O;
(2)f电极为阴极,发生还原反应,电极反应式为2H++2e-=H2↑,电解反应发生后,电极附近溶液显碱性,向此电极区域滴入酚酞,溶液变红色;氢离子浓度减小,该电极区域水的电离平衡受到促进,故答案为:2H++2e-=H2↑;溶液变红;促进;
(3)丙装置为电解硫酸钠溶液,相当于电解水,电解后电解质溶液pH不变,故答案为:不变;硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变;
(4)CH4的体积为22.4L(标准状况下),甲烷的物质的量为1mol,根据CH4+10OH--8e-=CO32-+7H2O可知,转移的电子为8mol,则丙装置中电解的水为4mol,质量为4mol×18g/mol=72g,因此需要加入72g水,可以将析出的沉淀溶解并恢复到原有浓度,故答案为:72。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案