题目内容
【题目】医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法![]() 制乙醇。
制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
i.![]()
ii.![]()
iii.![]()
随着反应进程,该过程能量变化如图所示。

下列有关说法正确的是_______(填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.![]() 和
和![]() 是反应的中间产物
是反应的中间产物
(2)已知:![]() 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正![]() ,v逆=k逆
,v逆=k逆![]() ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇:![]() 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量![]() 和
和![]() 发生上述反应,
发生上述反应,![]() 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。

(1)投料比由大到小的顺序为___________。
(2)若投料比![]() ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. ![]() 的体积分数不再变化
的体积分数不再变化
d.容器内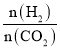 不再变化
不再变化
e.断裂![]() 个H—H键的同时生成
个H—H键的同时生成![]() 个水分子
个水分子
(3)若![]() ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数![]() 的数值为_______(
的数值为_______(![]() 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时![]() 的转化率___________50%(填“>”、“=”或“<”)。
的转化率___________50%(填“>”、“=”或“<”)。
【答案】bc d ![]() ce
ce ![]() <
<
【解析】
I.(1) a.从能量图中分析可以,该反应过程的三步中,第一步吸热,二、三步均释放能量,a错误;
b.活化能的定义:活化分子的平均能量与反应物分子的平均能量之差。活化能越来大,活化分子所占的百分数就越小,反应越慢,第i步反应的活化能最大,决定总反应速率,b正确;
c.从题中三步反应可知,![]() 和
和![]() 是反应的中间产物,c正确。
是反应的中间产物,c正确。
故答案为:bc。
(2)若其他条件不变时,降低温度,正逆反应速率均减小,而浓度在那瞬间是不变的,所以k正、k逆均减小,再根据能量图,![]() 反应物总能量大于生成物,为放热反应,降低温度,平衡正移,逆反应速率减小的更多,即k正减小的倍数小于k逆,d合理。故答案选:d。
反应物总能量大于生成物,为放热反应,降低温度,平衡正移,逆反应速率减小的更多,即k正减小的倍数小于k逆,d合理。故答案选:d。
Ⅱ. (1)投料比 越大,根据反应
越大,根据反应![]() ,在相同温度时,相当于增大H2的浓度,
,在相同温度时,相当于增大H2的浓度,![]() 的平衡转化率更高,即
的平衡转化率更高,即![]() ,故答案为:
,故答案为:![]() ;
;
(2)若投料比![]() ,一定温度下:a.密度等于气体质量与容器体积的比值,在
,一定温度下:a.密度等于气体质量与容器体积的比值,在![]() 中,物质均为气体,保持压强为5MPa,随反应正向进行,容器体积减小,密度增大,密度不变,说明该反应达到平衡,a能;b.平均相对分子质量等于气体总质量与气体总物质的量的比值,随反应正向进行,气体总质量不变,总物质的量减小,平均相对分子质量增大,当平均相对分子质量不再变化时,该反应达到平衡,b能;c.
中,物质均为气体,保持压强为5MPa,随反应正向进行,容器体积减小,密度增大,密度不变,说明该反应达到平衡,a能;b.平均相对分子质量等于气体总质量与气体总物质的量的比值,随反应正向进行,气体总质量不变,总物质的量减小,平均相对分子质量增大,当平均相对分子质量不再变化时,该反应达到平衡,b能;c. ![]() 的体积分数即物质的量分数,反应前
的体积分数即物质的量分数,反应前![]() 的体积分数为50%,根据极极法可以求出当氢气完全消耗之后,二氧化碳的体积分数仍为50%,故反应中
的体积分数为50%,根据极极法可以求出当氢气完全消耗之后,二氧化碳的体积分数仍为50%,故反应中![]() 的体积分数始终保持为50%不变,故不能据此判断该反应是否达到平衡标志,c不能;d.容器内
的体积分数始终保持为50%不变,故不能据此判断该反应是否达到平衡标志,c不能;d.容器内 反应前为1:1,而反应中系数不是1:1,当容器内
反应前为1:1,而反应中系数不是1:1,当容器内 不再变化时,则该反应达到平衡,d能;e.断裂H—H键,生成水分子,均为正反应,不能说明正反应速率等于逆反应速率,e不能。故答案为:ce;
不再变化时,则该反应达到平衡,d能;e.断裂H—H键,生成水分子,均为正反应,不能说明正反应速率等于逆反应速率,e不能。故答案为:ce;
(3)若![]() ,则A点温度下,CO2的平衡转化率为50%,
,则A点温度下,CO2的平衡转化率为50%,
![]()
起: 1mol 3mol 0mol 0mol
转: 1×50%mol 1.5mol 0.25mol 0.75mol
平: 0.5mol 1.5mol 0.25mol 0.75mol
平衡时气体的总物质的量=(0.5+1.5+0.25+0.75)mol=3mol,则![]() =
=![]() ,
,![]() =
=![]() ,
,![]() ,
,![]() ,该反应的平衡常数
,该反应的平衡常数 =
= =
=![]() ;原题是同温同压下,正反应体积减小,现为刚性密闭容器,气体的物质的量减小,相当于减压,平衡向气体分子数增大的方向移动,即向逆反应方向移动,
;原题是同温同压下,正反应体积减小,现为刚性密闭容器,气体的物质的量减小,相当于减压,平衡向气体分子数增大的方向移动,即向逆反应方向移动,![]() 的转化率小于50%,故答案为:
的转化率小于50%,故答案为:![]() ,<。
,<。