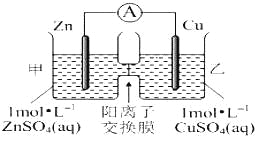
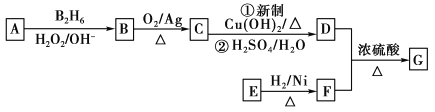
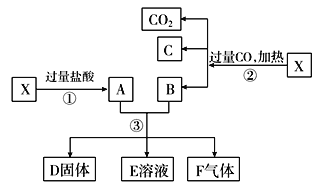
题目内容
【题目】现有42.4g由Fe、Al、Al2O3组成的混合物,将固体混合物分成两等份,将其中一份加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g;将另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,欲使该反应后溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A. 300mL B. 600mL C. 800mL D. 900mL
【答案】C
【解析】
将42.4g由Fe、Al、Al2O3的混合物分成两等份,其中一份为21.2g加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g即Fe的质量为5.6g,则设混合物中Al、Al2O3的物质的量分别为x、y,所以有27g/mol×x+102g/mol×y=15.6g![]() ①;
①;
另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,
Fe+H2SO4=FeSO4+H2↑, 2Al+3H2SO4=Al2(SO4)3+3H2↑,
0.1mol 0.1mol x ![]() x
x
Al2O3+3H2SO4=Al2(SO4)3+3H2O,
y 3y
所以有:0.1+ ![]() x=
x=![]() mol
mol![]() ②;联立①②方程,解得x=0.2mol,y=0.1mol。
②;联立①②方程,解得x=0.2mol,y=0.1mol。
由反应式可知,反应后溶液中含有0.1molFe2+、0.4molAl3+,剩余的H+为:2mol/L×0.6L×2-0.1mol×2-0.2mol×3-0.1mol×3×2=1.0mol,
欲使该反应后溶液中的金属离子完全沉淀,加入3mol/LNaOH溶液,发生的反应有:
H++OH-=H2O,Fe2++2OH-=Fe(OH)2↓,Al3++3OH-=Al(OH)3↓,
1.0mol 0.1mol 0.4mol
需要NaOH的物质的量为:1.0mol+0.1mol×2+0.4mol×3=2.4mol,
需要NaOH溶液的体积是![]() =0.8L=800mL。
=0.8L=800mL。
答案选C。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。