题目内容
13.下列有关实验装置进行的相应实验,能达到实验目的是( )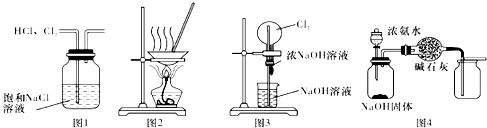
| A. | 用图1所示装置除去HCl中含有的少量Cl2 | |
| B. | 用图2所示装置将硫酸铜溶液蒸干,制备胆矾 | |
| C. | 用图3所示装置可以完成“喷泉”实验 | |
| D. | 用图4所示装置制取并收集干燥纯净的NH3 |
分析 A.HCl极易溶于水;
B.蒸干时硫酸铜晶体失去结晶水;
C.挤压胶头滴管,氯气与碱反应,使烧瓶的内压小于外因,形成喷泉;
D.氨气的密度比空气的密度小.
解答 解:A.HCl极易溶于水,则将HCl原物质除去,不能除杂,故A错误;
B.蒸干时硫酸铜晶体失去结晶水,应蒸发浓缩、冷却结晶制备胆矾,故B错误;
C.挤压胶头滴管,氯气与碱反应,使烧瓶的内压小于外因,形成喷泉,则图3所示装置可以完成“喷泉”实验,故C正确;
D.氨气的密度比空气的密度小,则图中为向上排空气法收集,应为向下排空气法收集,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备及收集、晶体制备、混合物分离提纯等,把握物质的性质、反应原理、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
19.在AgNO3溶液中加人铜粉和铁粉的混合物,反应完成后,向剩余固体中加稀H2SO4,无气体放出,则下列说怯正确的是( )
| A. | 剩余固体一定有铜 | B. | 反应后的溶液呈蓝色 | ||
| C. | 剩余固体中一定有银 | D. | 反应后的溶液为无色 |
4.在容积为1L的密闭容器中.装有4mol NO2,在一定温度时进行下面的反应:2NO2(g)?N2O4(g),在该温度下反应的平衡常数K=0.25,则平衡时该容器中NO2的物质的量为( )
| A. | 0mol | B. | 1mol | C. | 2mol | D. | 3mol |
1.下列说法错误的是( )
| A. | 在标准状况下,NA个CHCl3分子所占的体积约为22.4L | |
| B. | 苯分子中的所有原子都在同一个平面上 | |
| C. | 点燃甲烷必须事先进行验纯 | |
| D. | 甲烷燃烧能放出大量的热,所以是一种很好的气体燃料 |
8.下列实验操作或装置正确的是( )
| A. |  点燃酒精灯 | B. |  检验气密性 | C. |  稀释浓硫酸 | D. |  收集氢气. |
18.下列图示实验合理的是( )


| A. | 图4为用浓硝酸溶液与铜反应制备并收集少量NO2 | |
| B. | 图2为制备少量氧气 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图1为证明非金属性强弱:S>C>Si |
5.含有N元素的化合物,下列关于判断错误的是( )
| A. | HNO3具有氧化性 | B. | NH3既具有氧化性又具有还原性 | ||
| C. | N2只具有还原性 | D. | NO2既具有氧化性又具有还原性 |
2.一定条件下,K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O,则下列判断正确的是( )
| A. | 生成0.3 mol Cl2时,转移电子的物质的量为0.6 mol | |
| B. | 该反应中,生成的Cl2的摩尔质量约为70.7 g/mol | |
| C. | 被0.1 mol K37ClO3氧化的H35Cl的物质的量为0.6 mol | |
| D. | 该反应中,H35Cl发生氧化反应,KCl是还原产物 |
3.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18gH2O 中含有的质子数是 10NA | |
| B. | 1mol 臭氧和 1mol 氧气含有相同的氧原子数 | |
| C. | 46g NO2 和 N2O4混合气体中含有的原子总数为 3NA | |
| D. | 等物质的量的干冰和葡萄糖中所含的碳原子数之比为 1:6,氧原子数之比为 1:3 |