题目内容
4.在容积为1L的密闭容器中.装有4mol NO2,在一定温度时进行下面的反应:2NO2(g)?N2O4(g),在该温度下反应的平衡常数K=0.25,则平衡时该容器中NO2的物质的量为( )| A. | 0mol | B. | 1mol | C. | 2mol | D. | 3mol |
分析 设平衡时N2O4为xmol,表示出平衡时各组分的物质的量,由于体积为1L,用物质的量代替浓度代入平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=0.25列方程计算解答.
解答 解:设平衡时N2O4为xmol,则:
2NO2(g)?N2O4(g)
开始(mol):4 0
转化(mol):2x x
平衡(mol):4-2x x
由于体积为1L,可以用物质的量代替浓度计算平衡常数,则K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{x}{(4-2x)^{2}}$=0.25,解得x=1或x=4(舍去),故平衡时该容器中NO2的物质的量为2x mol=2mol,
故选:C.
点评 本题考查化学平衡的有关计算,涉及化学平衡常数,注意理解掌握化学平衡常数的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.在两个容积相同的容器中,一个盛有C2H4气体,另一个盛有N2和CO的混合气体.在同温同压下,两容器内的气体一定相同的物理量有几项( )
(1)分子数 (2)原子数 (3)质量 (4)电子数 (5)密度 (6)摩尔质量 (7)气体摩尔体积.
(1)分子数 (2)原子数 (3)质量 (4)电子数 (5)密度 (6)摩尔质量 (7)气体摩尔体积.
| A. | 4项 | B. | 5项 | C. | 6项 | D. | 7项 |
11.在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,氧化剂与还原剂的质量之比是( )
| A. | 3:8 | B. | 32:21 | C. | 21:32 | D. | 21:8 |
12.将等物质的量的A、B混合于1L的密闭容器中,发生反应:2A(g)+B(g)?2C(g)+D(?),5min时,测得密闭容器内气体压强减小,且c(A):c(B)=3:4,5min内,v(A)=0.2mol•L-1•minL-1,下列有关结论正确的是( )
| A. | D为气体 | B. | B的转化率为80% | ||
| C. | 5min时,c(A)=1.5mol•L-1 | D. | 反应开始前A的物质的量为2mol |
9.工业生产硝酸的第一步反应为4NH3(g)+5O2(g)?4NO(g)+6H2O(g),△H<0,保持一定温度不变,在体积为1L的恒容密闭容器中发生上述可逆反应,下表记录的是不同时间容器内各物质的物质的量
0~2min内的反应速率v(NH3)=0.1mol/(L.min),该温度下,上述可逆反应的平衡常数K=11.4.
| 物质的量(mol) 时间(min) | n(NH3) | n(O2) | n(H2O) |
| 0 | 2.00 | 2.25 | 0 |
| 第2min | 1.80 | 2.00 | 0.30 |
| 第4min | 1.60 | 1.75 | 0.60 |
| 第6min | 1.00 | 1.00 | 1.50 |
| 第8min | 1.00 | 1.00 | 1.50 |
16.16O和18O是氧元素的两种核素,用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 在18g 16O2中含有NA个氧原子 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 在标准状况下,1.12L 16O2和1.12L 18O2均含有0.1NA个氧原子 | |
| D. | 18O2和16O2化学性质相同 |
13.下列有关实验装置进行的相应实验,能达到实验目的是( )
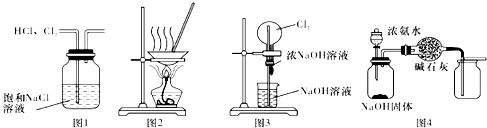

| A. | 用图1所示装置除去HCl中含有的少量Cl2 | |
| B. | 用图2所示装置将硫酸铜溶液蒸干,制备胆矾 | |
| C. | 用图3所示装置可以完成“喷泉”实验 | |
| D. | 用图4所示装置制取并收集干燥纯净的NH3 |
14.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,22.4 L CO2含有2NA个氧原子 | |
| B. | 1 mol•L-1 NaOH溶液中含有NA个Na+ | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温常压下,28g氮气所占的体积为22.4 L |
 一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象:
一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象: