题目内容
【题目】黄铁矿因其浅黄铜色和明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]:测定硫元素的含量
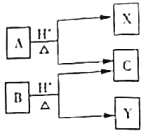
I.将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。
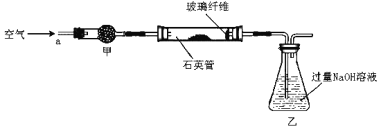
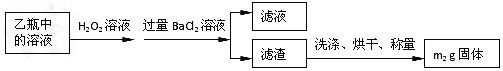
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)写出石英管中发生反应的化学方程式为:_________________________________。
(2)I中,干燥管甲内所盛试剂是__________,有同学提出该实验装置存在安全隐患,请用简洁的文字说明:_________________________________________。
(3)该黄铁矿石中硫元素的质量分数为_____________________。
[实验二]:设计以下实验方案测定铁元素的含量
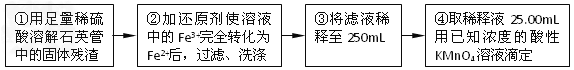
问题讨论:
(4)②中,若选用铁粉作还原剂,会使测量结果______(填“不影响”、“偏高”或“偏低”)。
(5)③中,需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有____________。
(6)④中发生反应的离子方程式为__________________________________________。
【答案】 ![]() 碱石灰(或氢氧化钠固体或氧化钙固体) 装置乙易发生倒吸
碱石灰(或氢氧化钠固体或氧化钙固体) 装置乙易发生倒吸 ![]() 偏高 250mL容量瓶 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
偏高 250mL容量瓶 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
【解析】试题分析:[实验一]:测定硫元素的含量
黄铁矿石(主要成分为FeS2)在空气中高温灼烧生成Fe2O3和SO2,结合实验装置图及流程图可得,从干燥管a端通入空气,除去二氧化碳,在石英管中高温氧化FeS2,产生的SO2气体通过盛氢氧化钠溶液的锥形瓶乙,被吸收;乙瓶中的吸收液被H2O2氧化后,与BaCl2溶液反应转化为BaSO4沉淀,再通过称量沉淀的质量测定该黄铁矿石中硫元素的质量分数。
[实验二]:测定铁元素的含量
稀硫酸溶解石英管中生成的Fe2O3,再还原为Fe2+,用酸性高锰酸钾标准液滴定,从而测定铁元素的含量。
(1)由题意,黄铁矿石(主要成分为FeS2)在空气中高温灼烧生成Fe2O3和SO2,所以石英管中发生反应的化学方程式为:4FeS2+11O2 ![]() 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(2)为防止空气中的二氧化碳对测定硫元素含量造成影响,所以干燥管中应盛有碱石灰(或氢氧化钠或氧化钙),吸收空气中的二氧化碳;由于产生的SO2气体较易溶于水,所以乙装置左边应加一个防倒吸装置,否则装置乙易发生倒吸。
(3)由已知可得,S元素质量为: ![]() g,所以m1g黄铁矿样品中S元素质量分数为:
g,所以m1g黄铁矿样品中S元素质量分数为: ![]() g÷m1 g×100%=
g÷m1 g×100%=![]() ×100% 。
×100% 。
(4)②中,若选用铁粉作还原剂,发生反应:Fe+2Fe3+=3Fe2+,使Fe2+增多,消耗酸性高锰酸钾增多,会使铁元素的含量测定结果偏高。
(5)配制250ml一定浓度的FeSO4溶液需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有250ml容量瓶。
(6)酸性KMnO4溶液氧化Fe2+的反应离子方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。