题目内容
氧元素有三种核素:16O、17O、18O,它们在自然界中所占的原子个数百分比分别为:a%、b%、c%,则下列说法正确的是( )
| A、一个16O原子的质量为16 g | ||
| B、氧元素的近似相对原子质量为(16a%+17b%+18c%) | ||
C、氧元素的近似相对原子质量为:
| ||
| D、氧元素的相对原子质量为(16a%+17b%+18c%) |
考点:核素,相对原子质量及其计算
专题:计算题
分析:A.1mol16O原子的质量为16个,1个16O的质量为
×16g=
g;
B.氧元素的近似相对原子量为各原子的相对原子量与其百分含量之积的和;
C.氧元素的近似原子质量不能简单的平均计算,应该为各原子的相对原子量与其百分含量之积的和;
D.相对原子质量不能用质量数求算,应该应该用真实质量比碳-12质量的
.
| 1 |
| NA |
| 16 |
| NA |
B.氧元素的近似相对原子量为各原子的相对原子量与其百分含量之积的和;
C.氧元素的近似原子质量不能简单的平均计算,应该为各原子的相对原子量与其百分含量之积的和;
D.相对原子质量不能用质量数求算,应该应该用真实质量比碳-12质量的
| 1 |
| 12 |
解答:
解:A.阿伏伽德罗常数个16O原子的质量为16g,1个16O的质量为
×16g=
g,故A错误;
B.16O、17O、18O在自然界中所占的原子个数百分比分别为:a%、b%、c%,则氧元素的近似相对原子质量为:(16a%+17b%+18c%),故B正确;
C.氧元素的近似相对原子质量不是氧元素各核素的简单平均数,氧元素的近似相对原子质量应该为:(16a%+17b%+18c%),故C错误;
D.(16a%+17b%+18c%)为氧元素的近似相对原子量,相对原子量需要用真实质量比碳-12质量的
,故D错误;
故选B.
| 1 |
| NA |
| 16 |
| NA |
B.16O、17O、18O在自然界中所占的原子个数百分比分别为:a%、b%、c%,则氧元素的近似相对原子质量为:(16a%+17b%+18c%),故B正确;
C.氧元素的近似相对原子质量不是氧元素各核素的简单平均数,氧元素的近似相对原子质量应该为:(16a%+17b%+18c%),故C错误;
D.(16a%+17b%+18c%)为氧元素的近似相对原子量,相对原子量需要用真实质量比碳-12质量的
| 1 |
| 12 |
故选B.
点评:本题考查了元素的相对原子量的计算,题目难度不大,注意掌握相对原子量的概念及求算方法,明确相对原子量与近似原子量之间的区别.

练习册系列答案
相关题目
下列各组微粒半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
(双项)下列说法正确的是( )
| A、氢键是一种化学键 |
| B、氢键使物质具有较高的熔、沸点 |
| C、能与水分子形成氢键的物质易溶于水 |
| D、水结成冰体积膨胀与氢键无关 |
下列实验能达到目的是( )
| A、用浓HNO3与Cu反应制备NO2 |
| B、用BaCl2溶液鉴别CO2与SO2 |
| C、用溴水鉴别苯和正已烷 |
| D、将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
CPAE是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程如下.下列说法不正确的是( )


| A、1mol CPAE与足量的NaOH溶液反应,最多消耗3mol NaOH |
| B、可用金属Na检测上述反应是否残留苯乙醇 |
| C、与苯乙醇互为同分异构体的酚类物质共有9种 |
| D、咖啡酸可发生聚合反应,而且其分子中含有3种官能团 |
下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同 |
| D、二者在一定的条件下可以相互转化 |
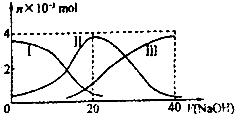 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大 |
| C、欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D、向NaHA溶液加人水的过程中,pH可能增大也可能减小 |
草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol?L-1 NaHC2O4溶液中滴加0.01mol?L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A、V(NaOH)=0时,c(H+)=1×10-2mol?L-1 |
| B、V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C、V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D、V(NaOH)>10mL时,一定有c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-) |