题目内容
【题目】标准状况下的a L H2和Cl2的混合气体,经光照充分反应后,所得气体恰好使溶液中b molNaOH完全转变为盐,则a、b的关系不可能是
A.b=a/22.4B.0<b<a/22.4C.b>a/22.4D.b≥a/11.2
【答案】D
【解析】
所发生的反应有:H2+Cl2![]() 2HCl,HCl+NaOH=NaCl+H2O,若Cl2过量还有:2NaOH+Cl2=NaCl+NaClO+H2O,由以上反应可知:n(NaOH)=2n(Cl2),故可用极值法求解。
2HCl,HCl+NaOH=NaCl+H2O,若Cl2过量还有:2NaOH+Cl2=NaCl+NaClO+H2O,由以上反应可知:n(NaOH)=2n(Cl2),故可用极值法求解。
所发生的反应有:H2+Cl2![]() 2HCl,HCl+NaOH=NaCl+H2O,若Cl2过量还有:2NaOH+Cl2=NaCl+NaClO+H2O,由以上反应可知:n(NaOH)=2n(Cl2),若a L全为 H2,消耗氢氧化钠的物质的量为b=0,若a L全为Cl2,消耗氢氧化钠的量最大:b=
2HCl,HCl+NaOH=NaCl+H2O,若Cl2过量还有:2NaOH+Cl2=NaCl+NaClO+H2O,由以上反应可知:n(NaOH)=2n(Cl2),若a L全为 H2,消耗氢氧化钠的物质的量为b=0,若a L全为Cl2,消耗氢氧化钠的量最大:b=![]() ,故对于二者混合都有时,消耗氢氧化钠的量b应介于0与
,故对于二者混合都有时,消耗氢氧化钠的量b应介于0与![]() 之间,即0<b<
之间,即0<b<![]() ;
;
答案选D。

【题目】氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。

(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。
(2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。
(3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。
(4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。
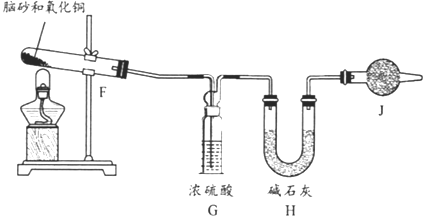
①为顺利完成有关物理量的测定,请完善下列表格:
测量时间点 | 加热前 | 当观察到_____现象时 |
测量内容 | _______________ | 停止加热,冷却,称量H装置的总质量 |
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。


