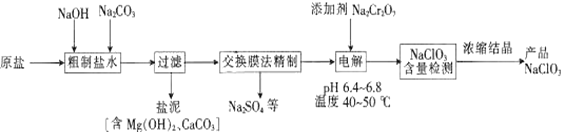
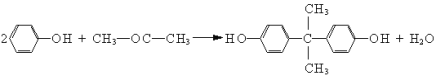
题目内容
【题目】一定条件下反应N2(g)+3H2(g) ![]() 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
A.1.2mol/(L·min)B.1.8mol/(L·min)
C.0.6mol/(L·min)D.0.4mol/(L·min)
【答案】A
【解析】
在10L的密闭容器中进行,测得2min内,N2的物质的量由20 mol减小到8 mol,则2min内NH3的反应速率v(N2)=![]() = 0.6mol/(L
= 0.6mol/(L![]() min),反应速率之比等于化学方程式计量数之比v(NH3)=2v(N2)=2×0.6mol/(L
min),反应速率之比等于化学方程式计量数之比v(NH3)=2v(N2)=2×0.6mol/(L![]() min)=1.2mol/(L
min)=1.2mol/(L![]() min),A项正确,
min),A项正确,
答案选A。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目