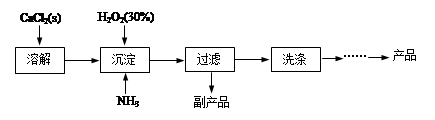
题目内容
S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种:
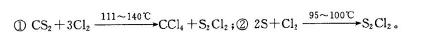 已知在S2Cl2中硫元素显+1价,电子式:
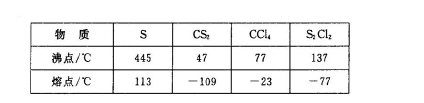
已知在S2Cl2中硫元素显+1价,电子式: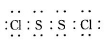 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
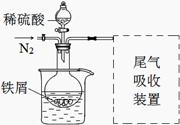
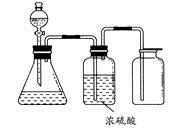
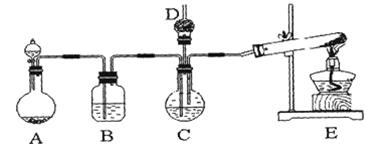
实验室利用下列装置制备 (部分夹持仪器已略去):
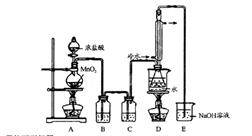
回答下列问题:
(1)写出A装置中发生反应的离子方程式
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是
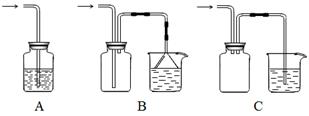
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中 实验。
(4)B装置中盛放的是 ,反应结束后从锥形瓶内混合物中分离出产品的方法是 ,D中采用热水浴加热的原因是
(5)A装置仪器装配时,整套装置装配完毕后,应先进行 ,再添加试剂。实验完毕,拆除装置时,应先将E中长导管移开液面,目的是
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是 (用离子方程式表示)。
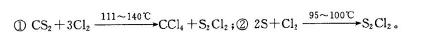 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: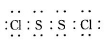 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
实验室利用下列装置制备 (部分夹持仪器已略去):

回答下列问题:
(1)写出A装置中发生反应的离子方程式
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中 实验。
| A.石油分馏 | B.制备乙烯 | C.制取乙酸乙酯 | D.制取溴苯 |
(5)A装置仪器装配时,整套装置装配完毕后,应先进行 ,再添加试剂。实验完毕,拆除装置时,应先将E中长导管移开液面,目的是
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是 (用离子方程式表示)。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)稀盐酸还原性弱,反应困难;
(3)C、D
(4)饱和食盐水 蒸馏;使CS2平稳汽化,避免产物S2Cl2汽化;
(5)气密性检查、防止倒吸
(6)2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑ ClO-+2H++Cl-=Cl2↑+H2O
 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O(2)稀盐酸还原性弱,反应困难;
(3)C、D
(4)饱和食盐水 蒸馏;使CS2平稳汽化,避免产物S2Cl2汽化;
(5)气密性检查、防止倒吸
(6)2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑ ClO-+2H++Cl-=Cl2↑+H2O
试题分析:在装置A中是实验室制取Cl2的化学反应。该反应的离子方程式为MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O (2)MnO2与浓盐酸发生反应,在该反应中浓盐酸表现还原性和酸性。由于稀盐酸还原性弱,反应困难。所以一般是用36.5%的浓溶液。(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置一般用于反应物受热容易挥发的沸点较低的物质发生的反应。可应用于下列高中化学中制取乙酸乙酯和溴苯。因此选项为C、D。(4)A装置用于制取Cl2。由于浓盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在装置B中用饱和NaCl溶液可以除去HCl,又可以减小氯气的溶解度。在装置C中用浓硫酸对氯气进行干燥,然后在装置D中发生反应制取S2Cl2。为了加快反应速率同时又减少反应物CS2及Cl2的挥发逸出,使CS2平稳汽化,也可避免产物S2Cl2汽化;用温水浴加热。反应结束后锥形瓶内混合物的沸点不同,分离出产品的方法是蒸馏。(5)制取气体的反应装置或由气体参加的化学反应装置在加入药品之前一定要先检查装置的气密性。实验完毕,拆除装置时,若显熄灭酒精灯,再将E中长导管移开液面就容易引起倒吸现象的发生。所以先将E中长导管移开液面就可防止倒吸现象的发生。(6)实验过程中,若缺少C干燥装置,S2Cl2就会发生歧化反应2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,产生难溶于水的S单质。使溶液变浑浊。当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O。
Mn2++Cl2↑+2H2O (2)MnO2与浓盐酸发生反应,在该反应中浓盐酸表现还原性和酸性。由于稀盐酸还原性弱,反应困难。所以一般是用36.5%的浓溶液。(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置一般用于反应物受热容易挥发的沸点较低的物质发生的反应。可应用于下列高中化学中制取乙酸乙酯和溴苯。因此选项为C、D。(4)A装置用于制取Cl2。由于浓盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在装置B中用饱和NaCl溶液可以除去HCl,又可以减小氯气的溶解度。在装置C中用浓硫酸对氯气进行干燥,然后在装置D中发生反应制取S2Cl2。为了加快反应速率同时又减少反应物CS2及Cl2的挥发逸出,使CS2平稳汽化,也可避免产物S2Cl2汽化;用温水浴加热。反应结束后锥形瓶内混合物的沸点不同,分离出产品的方法是蒸馏。(5)制取气体的反应装置或由气体参加的化学反应装置在加入药品之前一定要先检查装置的气密性。实验完毕,拆除装置时,若显熄灭酒精灯,再将E中长导管移开液面就容易引起倒吸现象的发生。所以先将E中长导管移开液面就可防止倒吸现象的发生。(6)实验过程中,若缺少C干燥装置,S2Cl2就会发生歧化反应2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,产生难溶于水的S单质。使溶液变浑浊。当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O。
练习册系列答案
相关题目