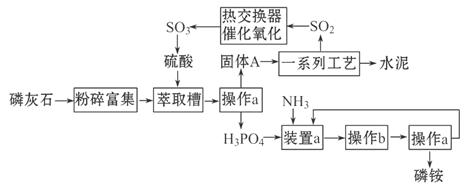
题目内容
(14分)某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ制取硫酸亚铁溶液
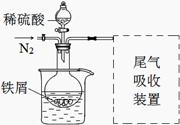
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
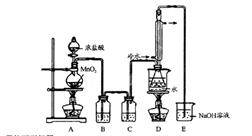
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
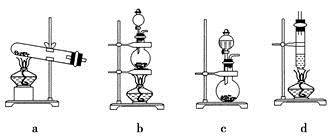
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
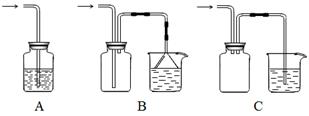
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ 晶体纯度测定
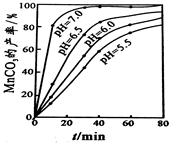
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3mol·L-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
Ⅰ制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。

(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
(5)下列装置适合尾气吸收的是 (填序号)。

Ⅲ 晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3mol·L-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
(1)2Fe+6H2SO4(浓)△Fe2(SO4)3+3SO2↑+6H2O(其他合理答案给分)(3分)
(2)防止Fe2+被氧化(2分) (3)均匀受热(2分) (4)抑制Fe2+的水解(2分)
(5)BC(2分) (6)①酸式(1分) ②93.96%(2分)
(2)防止Fe2+被氧化(2分) (3)均匀受热(2分) (4)抑制Fe2+的水解(2分)
(5)BC(2分) (6)①酸式(1分) ②93.96%(2分)
试题分析:(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体,该气体应该是二氧化硫,溶液显黄色,说明有铁离子产生。这说明在加热的条件下硫酸与铁反应生成了硫酸铁、二氧化硫和水,反应的化学方程式为2Fe+6H2SO4(浓)△Fe2(SO4)3+3SO2↑+6H2O。
(2)亚铁离子极易被氧化,而铁具有还原性,因此铁过量的目的是防止Fe2+被氧化。
(3)水浴加热除了便于控制温度外,还有的优点是受热均匀。
(4)在溶液中亚铁离子易水解,溶液显酸性。因此调节pH=2的目的是控制亚铁离子水解。
(5)二氧化硫易溶于水,直接吸收容易引起液体倒流,所以A装置不正确,BC装置正确,答案选BC。
(6)①高锰酸钾溶液具有强氧化性,因此高锰酸钾标准溶液应盛装在酸式滴定管中。
②消耗0.02000 mol·L-1高锰酸钾的物质的量是0.02000 mol·L-1×0.01690L=0.000338mol。则根据方程式可知消耗亚铁离子的物质的量是0.000338mol×5=0.00169mol,因此硫酸亚铁晶体的质量=0.00169mol×278g/mol=0.46982g,所以纯度为
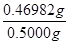 ×100%=93.96%。
×100%=93.96%。
练习册系列答案
相关题目
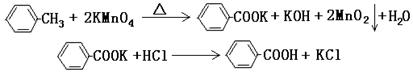
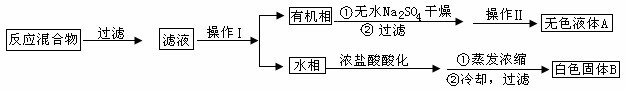


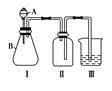 (4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题:
(4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题: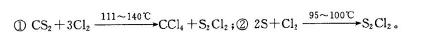 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: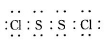 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: