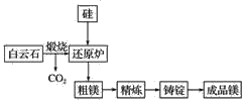
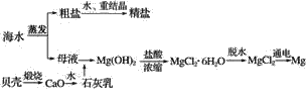
题目内容
【题目】已知298K,1.01×105Pa条件下:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
A. - 41.1 kJ·mol-1B. + 200.7 kJ·mol-1
C. - 766.5 kJ·mol-1D. + 41.1 kJ·mol-1
【答案】A
【解析】
已知①2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,②CO(g)+![]() O2(g)=CO2(g) △H=-282.9kJ·mol-1,则根据盖斯定律可知(②×2-①)÷2即可得到该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热△H=-41.1 kJ·mol-1,答案选A。
O2(g)=CO2(g) △H=-282.9kJ·mol-1,则根据盖斯定律可知(②×2-①)÷2即可得到该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热△H=-41.1 kJ·mol-1,答案选A。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验 序号 | 实验温 度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶 液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出_____(填外部因素)的改变对反应速率的影响,其中V1=_____,T1=______;通过实验________可探究出温度变化对化学反应速率的影。
(2)若t1<8,则由此实验可以得出的结论是_________;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=______。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式__________。
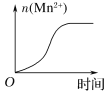
(4)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是___________,相应的粒子最可能是(填序号)______。
【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应制备:![]() +HNO3
+HNO3![]()
![]() +H2O △H<0,已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
+H2O △H<0,已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
物质 | 苯 | 硝基苯 | 间二硝基苯 | 浓硝酸 | 浓硫酸 |
沸点/℃ | 80 | 211 | 301 | 83 | 338 |
溶解性 | 微溶于水 | 难溶于水 | 微溶于水 | 易溶于水 | 易溶于水 |
下列说法不正确的是( )
A.分液后的有机层,采用蒸馏的方法可将硝基苯首先分离出来
B.制备硝基苯的反应类型为取代反应
C.该反应温度控制在50~60℃的原因是减少反应物的挥发和副产物的生成
D.采用加入NaOH溶液、水洗涤、以及分液的方法可除去粗硝基苯中混有的无机杂质