题目内容
【题目】【2017金凤区校级三模】一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.
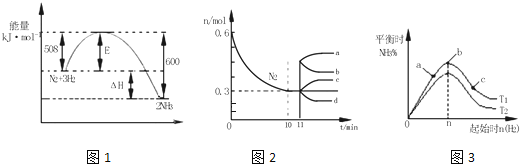
①由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 ;
②图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)。
【答案】① 0.045mol/Lmin d ② c <
【解析】①图象分析2L的密闭容器中,V(N2)=![]() V(H2)=
V(H2)=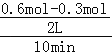 =0.015mol/Lmin,V(H2)=0.045mol/Lmin;从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;
=0.015mol/Lmin,V(H2)=0.045mol/Lmin;从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;
②图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高;由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,温度越高化学平衡越低,故K1>K2。

练习册系列答案
相关题目