题目内容
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸干,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
D
解析试题分析:氯化铜是能水解的强酸弱碱盐,其水解反应是吸热反应,加热蒸干其溶液时,氯化铜与水彻底反应生成氢氧化铜和盐酸,氢氧化铜受热易分解为氧化铜和水,盐酸和水具有挥发性,因此得到氧化铜固体,不可制取无水氯化铜,故A选项错误;碳酸氢铵饱和溶液加热蒸干时,不仅水易挥发,而且碳酸氢铵受热易分解为氨气、二氧化碳和水蒸气,因此最终没有固体剩余,不能制取碳酸氢铵固体,故B选项错误;氨水的碱性比氢氧化铁强,则氯化铁饱和溶液与氨水发生复分解反应,得到氢氧化铁沉淀,不能制取氢氧化铁胶体,故C选项错误;电石主要成分是CaC2,碳化钙与水溶液剧烈反应,生成氢氧化钙和乙炔,饱和食盐水能降低反应速率,使反应安全、平稳地进行,因此可用于制取乙炔,故D选项正确。
考点:考查化学实验基本操作,涉及盐类水解、温度对水解平衡移动的影响规律、盐的热稳定性、氢氧化胶体和沉淀的制备、乙炔的实验室制法等。

 智慧小复习系列答案
智慧小复习系列答案下列方法中,不能用于实验室制取氨气的是
| A.将烧瓶中的浓氨水加热 |
| B.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 |
| C.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热 |
| D.加热试管中的氯化铵固体 |
下列装置或操作与实验目的最相符的是
| A.①——实验室制取并收集足量NH3 |
| B.②——以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置 |
| C.③——检查装置气密性 |
| D.④——利用排空气法收集CO2 |
用下列两种方法制取氯气:①用含氯化氢146 g的浓盐酸与足量的二氧化锰反应 ②用87 g二氧化锰与足量的浓盐酸反应,则所得氯气
| A.②比①多 | B.①比②多 | C.一样多 | D.无法比较 |
下图所示装置中,若关闭活塞,则品红溶液无变化,石蕊溶液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )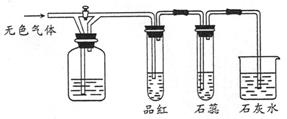
| A.SO2和H2SO4(浓) |
| B.SO2和饱和NaHCO3 |
| C.Cl2和NaHSO3 |
| D.NO2和KOH |
在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是
| A.防止氯气扩散到空气中造成污染 | B.便于控制加入盐酸的量 |
| C.长颈漏斗不便于添加液体 | D.尽量避免HCl挥发到空气中 |
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
(1)除去ClO2中的NH3可选用的试剂是 ;可用于制取NH3的是________(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 E.NH4HCO3 |
(3)写出电解时阳极发生的电极反应式_
(4)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
②测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。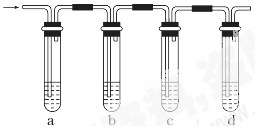
(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
