题目内容
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
(1)除去ClO2中的NH3可选用的试剂是 ;可用于制取NH3的是________(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 E.NH4HCO3 |
(3)写出电解时阳极发生的电极反应式_
(4)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
②测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
(1)C (2分);BE (2分)
(2)6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH (3分)
(3)NH4++3Cl- -6e-=NCl3+4H+(3分)
(4)①2ClO2+10I-+8H+=2Cl-+5I2+4H2O (3分)
②1.35×10-2CV(g)(3分)
解析试题分析:(1)ClO2 易溶于水,NH3 又显碱性,因此要除去混有的氨气,应该选择浓硫酸(2分);制备氨气可以选择铵盐和强碱制备。(2分)
(2)根据已给出的反应物和生成物中化合价判断该反应是个氧化还原反应,由于有氨气产生,所以反应物必然有H2O参加,相应的就会生成NaCl 、NaOH 。
(3)电解在酸性条件下进行,阴极发生还原反应析出H2,电极反应式:6H++6e-=3H2,阳极发生氧化反应,NH4+被氧化成NCl3 ,有H+生成,电极反应式:NH4++3Cl- -6e-=NCl3+4H+(3分)
(4)ClO2 有较强氧化性,把I- 氧化为I2 ,在酸性条件下,考虑有H+参加生成H2O (3分)
②根据反应方程式得出三者关系
ClO2 ~I2~S2O32-
2 : 5 :10
m(ClO2)=n(ClO2)×M(ClO2)=0.2n(S2O32-)×M(ClO2)=0.2×Cmol/L×V×10-3 L×67.5g/mol=1.35×10-2CV(g)(3分)
考点:本题是一道化工流程题,主要考查的是干燥剂的选择、氧化还原反应方程式的配平、电极反应式的书写、氧化还原滴定的计算等,考查内容丰富,综合性强,需要有比较好的方法。

 名校课堂系列答案
名校课堂系列答案用如图所示的装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
| 选项 | 气体 | a | b | c |
| A | CO2 | 稀盐酸 | 石灰石 | 浓硫酸 |
| B | SO2 | 浓硫酸 | 铁片 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | Cl2 | 浓盐酸 | MnO2粉末 | 浓硫酸 |
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸干,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备。
工业上生产CaO2·8H2O的主要流程如下: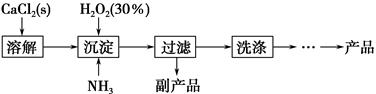
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________。
(2)沉淀时常用冰水控制温度在10 ℃以下和通入过量的NH3,其可能原因分别是①__________________________;②_____________________________。
Ⅱ.过氧化钙晶体含量的测定。
准确称取0.300 0 g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.020 0 mol·L-1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
滴定终点观察到的现象为_______________________________________。
(4)根据表中数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)。
KMnO4标准溶液滴定数据
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.300 0 | 1.02 | 24.04 |
| 2 | 0.300 0 | 2.00 | 25.03 |
| 3 | 0.300 0 | 0.20 | 23.24 |
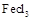 易升华。工业上制备无水的
易升华。工业上制备无水的
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。

 I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)

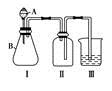 (4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题:
(4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题: