题目内容
下列装置或操作与实验目的最相符的是
| A.①——实验室制取并收集足量NH3 |
| B.②——以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置 |
| C.③——检查装置气密性 |
| D.④——利用排空气法收集CO2 |
C
解析试题分析:A、收集氨气时不能为密封容器,且集气瓶口要塞一团蘸有稀硫酸的棉花团,图中收集装置不合理,故A错误;B、以溴化钾、90%硫酸、乙醇为原料合成溴乙烷,蒸馏得到溴乙烷,但乙醇易挥发,溴乙烷不纯,故B错误;C、由图中装置可知,关闭止水夹,从长颈漏斗加水,在长颈漏斗的下端能形成一段水柱,以此来检查装置的气密性,故C正确;D、二氧化碳的密度比空气的大,应利用向上排空气法收集,图中装置应长进短出,故D错误,答案选C。
考点:考查化学实验方案的评价;氨的实验室制法;气体发生装置的气密性检查;气体的收集等

用如图所示的装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
| 选项 | 气体 | a | b | c |
| A | CO2 | 稀盐酸 | 石灰石 | 浓硫酸 |
| B | SO2 | 浓硫酸 | 铁片 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | Cl2 | 浓盐酸 | MnO2粉末 | 浓硫酸 |
下列气体中,既可用浓H2SO4干燥,又可用固体NaOH干燥的是
| A.Cl2 | B.NH3 | C.SO2 | D.O2 |
下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是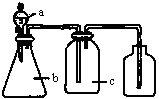
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3 |
| C | NO | 稀硝酸 | 铜屑 | H2O |
| D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
用下图装置不能完成气体制取任务的是
| A.过氧化钠和水反应制取氧气 |
| B.生石灰和浓氨水反应制取氨气 |
| C.二氧化锰和浓盐酸反应制取氯气 |
| D.碳化钙和饱和食盐水反应制取乙炔 |
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸干,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备。
工业上生产CaO2·8H2O的主要流程如下: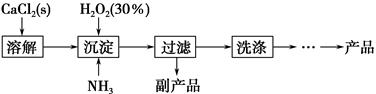
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________。
(2)沉淀时常用冰水控制温度在10 ℃以下和通入过量的NH3,其可能原因分别是①__________________________;②_____________________________。
Ⅱ.过氧化钙晶体含量的测定。
准确称取0.300 0 g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.020 0 mol·L-1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
滴定终点观察到的现象为_______________________________________。
(4)根据表中数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)。
KMnO4标准溶液滴定数据
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.300 0 | 1.02 | 24.04 |
| 2 | 0.300 0 | 2.00 | 25.03 |
| 3 | 0.300 0 | 0.20 | 23.24 |
下列气体:①NH3 ②NO2 ③NO ④O2 ⑤SO2中,适于用下图装置制取和收集的气体是( )
| A.①② | B.②③ | C.③④ | D.②⑤ |
 I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)