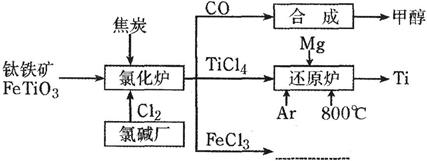
题目内容
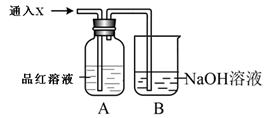
下图所示装置中,若关闭活塞,则品红溶液无变化,石蕊溶液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )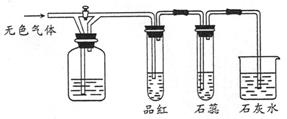
| A.SO2和H2SO4(浓) |
| B.SO2和饱和NaHCO3 |
| C.Cl2和NaHSO3 |
| D.NO2和KOH |
B
解析试题分析:关闭活塞,则品红溶液无变化,石蕊溶液变红,石灰水变浑浊,这说明无色气体中一定含有CO2或提高洗气瓶中有CO2生成。A中浓硫酸不能吸收SO2,品红溶液褪色,不符合题意;B中通入饱和NaHCO3溶液后发生反应:SO2+NaHCO3═Na2SO3+2CO2↑+H2O,SO2被吸收而放出CO2,所以品红溶液无变化,石蕊溶液变红,石灰水变浑浊,,符合题意;C中氯气是黄绿色气体,且具有强氧化性,能把亚硫酸氢钠氧化生成硫酸钠,没有气体溢出,不符合题意;D中NO2是红棕色气体,通入到KOH溶液中NO2被吸收,,没有气体溢出,不符合题意,答案选B。
考点:考查SO2、氯气和NO2以及CO2的性质、物质的检验
点评:该题是中等难度的试题,侧重对学生实验能力的培养,有助于培养学生分析、归纳和总结问题的能力。本题根据现象来推测物质,然后再进行一一验证,这也是解决问题的一种方法,需要学生注意总结、归纳和应用。

用右图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是
| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 稀硫酸 | 亚硫酸钠 | 溴水 | 橙色褪去 | SO2具有漂白性 |
| B | 饱和食盐水 | 电石 | 酸性 KMnO4溶液 | 紫色褪去 | 乙炔可发生氧化反应 |
| C | 醋酸 | 碳酸钠 | BaCl2溶液 | 变浑浊 | 醋酸酸性强于碳酸 |
| D | 浓氨水 | 生石灰 | AgNO3溶液 | 无明显现象 | NH3与 AgNO3溶液不反应 |
下列气体中,既可用浓H2SO4干燥,又可用固体NaOH干燥的是
| A.Cl2 | B.NH3 | C.SO2 | D.O2 |
用下图装置不能完成气体制取任务的是
| A.过氧化钠和水反应制取氧气 |
| B.生石灰和浓氨水反应制取氨气 |
| C.二氧化锰和浓盐酸反应制取氯气 |
| D.碳化钙和饱和食盐水反应制取乙炔 |
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸干,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
下列反应适用于实验室制备氧气的是
①高锰酸钾热分解 2KMnO4 K2MnO4+MnO2+ O2↑
K2MnO4+MnO2+ O2↑
②硝酸铵热分解 2NH4NO3 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑
③过氧化氢催化分解 2H2O2 2H2O +O2↑
2H2O +O2↑
④二氧化氮热分解 2NO2 2NO+ O2↑
2NO+ O2↑
| A.只有① | B.①和② | C.①和③ | D.①③④ |
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备。
工业上生产CaO2·8H2O的主要流程如下: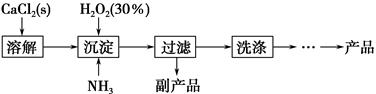
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________。
(2)沉淀时常用冰水控制温度在10 ℃以下和通入过量的NH3,其可能原因分别是①__________________________;②_____________________________。
Ⅱ.过氧化钙晶体含量的测定。
准确称取0.300 0 g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.020 0 mol·L-1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
滴定终点观察到的现象为_______________________________________。
(4)根据表中数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)。
KMnO4标准溶液滴定数据
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.300 0 | 1.02 | 24.04 |
| 2 | 0.300 0 | 2.00 | 25.03 |
| 3 | 0.300 0 | 0.20 | 23.24 |