题目内容
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母).

(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
【答案】 放热 增大 增大 AC 24%
【解析】(1)根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应放热,故答案为:放热;
(2)温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,故答案为:增大;增大;
(3)根据830℃时,平衡常数k=1计算;
A、Q= (2×3)÷(5×1)=1.2>1,反应向逆反应方向移动,故A正确;
B、Q= (2.4×1.5)÷(2×2)=0.9<1,反应向正反应方向移动,故B错误;
C、Q= (3.2×2.5)÷(3.5×2)=1.14>1,反应向逆反应方向移动,故C正确;
D、Q= (0.5×2)÷(1×1)=1,达到平衡状态,平衡不移动,故D错误。
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,设一氧化碳转化物质的量为x,依据平衡三段式列式得到
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始量(mol): 4 6 0 0
变化量(mol): x x x x
平衡量(mol):4-x 6-x x x
平衡常数K= x2÷(4-x)×(6-x)=1 x=2.4mol
H2的体积分数= 2.4 ÷(1.6+3.6+2.4+2.4)×100%=24% 。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
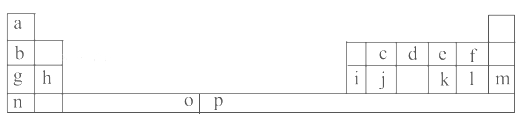
试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
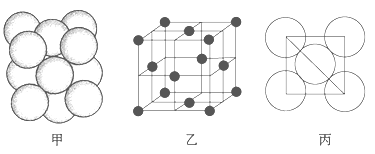
请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。


