题目内容
常温下,将等物质的量的铜片、铁片、铝片、银片分别置于4个小烧杯中,然后各加入足量的浓硝酸,放出NO2气体的体积最多的是
- A.铜片
- B.铁片
- C.银片
- D.铝片
A
分析:常温下,Fe、Al遇浓硝酸发生钝化反应,而不能反应完全,而Cu、Ag能与浓硝酸反应,利用金属失去的电子数越多,则生成的气体越多来分析.
解答:设等物质的量的铜片、铁片、铝片、银片的物质的量为1mol,加入足量的浓硝酸,
A、1molCu失去的电子数为1mol×2=2mol,生成气体的物质的量为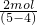 =2mol;
=2mol;
B、常温下,Fe遇浓硝酸发生钝化反应,而不能反应完全;
C、1molAg失去的电子数为1mol×1=1mol,生成气体的物质的量为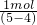 =1mol;
=1mol;
D、常温下,Al遇浓硝酸发生钝化反应,而不能反应完全;
显然A中气体的物质的量最大,气体的体积最大,
故选A.
点评:本题考查浓硝酸的性质,明确电子守恒的计算即可解答,并注意常温下Fe、Al遇浓硝酸发生钝化反应是学生解答中的易错点.
分析:常温下,Fe、Al遇浓硝酸发生钝化反应,而不能反应完全,而Cu、Ag能与浓硝酸反应,利用金属失去的电子数越多,则生成的气体越多来分析.
解答:设等物质的量的铜片、铁片、铝片、银片的物质的量为1mol,加入足量的浓硝酸,
A、1molCu失去的电子数为1mol×2=2mol,生成气体的物质的量为
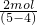 =2mol;
=2mol;B、常温下,Fe遇浓硝酸发生钝化反应,而不能反应完全;
C、1molAg失去的电子数为1mol×1=1mol,生成气体的物质的量为
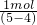 =1mol;
=1mol;D、常温下,Al遇浓硝酸发生钝化反应,而不能反应完全;
显然A中气体的物质的量最大,气体的体积最大,
故选A.
点评:本题考查浓硝酸的性质,明确电子守恒的计算即可解答,并注意常温下Fe、Al遇浓硝酸发生钝化反应是学生解答中的易错点.

练习册系列答案
相关题目
常温下,将等物质的量浓度、等体积的烧碱溶液和乙酸溶液混合,充分反应后溶
液的pH
| A.小于7 | B.大于7 | C.等于7 | D.无法判断 |




