题目内容
【题目】实验室用如图所示装置制备乙炔,并验证乙炔的某些化学性质,已知制备的乙炔气体中往往含有少量的![]() 气体。请回答下列问题:
气体。请回答下列问题:

(1)实验室制备乙炔的化学方程式为________;为了使产生乙炔的气流平稳,装置![]() 的分液漏斗中常用______________代替水。
的分液漏斗中常用______________代替水。
(2)装置![]() 中
中![]() 溶液的作用是________,发生反应的离子方程式为_________。
溶液的作用是________,发生反应的离子方程式为_________。
(3)装置![]() 中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
(4)装置![]() 中观察到的现象是________。
中观察到的现象是________。
【答案】![]() 饱和食盐水 除去
饱和食盐水 除去![]() 气体
气体 ![]() 溶液的橙红色逐渐褪去
溶液的橙红色逐渐褪去 ![]() (或
(或![]() ) 加成反应 溶液的紫红色逐渐褪去
) 加成反应 溶液的紫红色逐渐褪去
【解析】
装置A中电石和水反应得到含有杂质的乙炔,通入B装置后,杂质![]() 被烧碱溶液吸收,通入C装置后乙炔发生加成反应,通入D装置后乙炔和酸性高锰酸钾溶液发生氧化还原反应,导致其褪色,据此来分析本题即可。
被烧碱溶液吸收,通入C装置后乙炔发生加成反应,通入D装置后乙炔和酸性高锰酸钾溶液发生氧化还原反应,导致其褪色,据此来分析本题即可。
(1)电石和水反应生成氢氧化钙和乙炔气体,反应的方程式为![]() ,为了使产生的乙炔气流平稳,应用饱和食盐水来替代水;
,为了使产生的乙炔气流平稳,应用饱和食盐水来替代水;
(2)根据分析,B中的烧碱可以吸收![]() 杂质,硫化氢与氢氧化钠溶液反应生成硫化钠和水,反应的离子反应方程式为
杂质,硫化氢与氢氧化钠溶液反应生成硫化钠和水,反应的离子反应方程式为![]() ;
;
(3)装置C中乙炔和溴水发生加成反应生成无色的卤代烷,则实验现象为溶液的橙红色逐渐褪去,反应的化学方程式为![]() (或
(或![]() );
);
(4)D中的酸性高锰酸钾溶液能被乙炔还原,导致溶液中的紫红色逐渐褪去。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
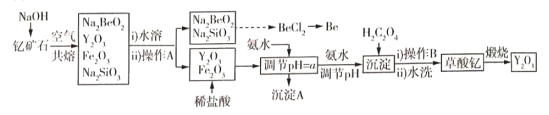
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。