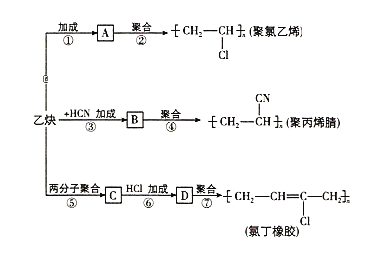
题目内容
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中 Fe2+和 Fe3+的浓度恰好相等。则已反应的 Fe3+和未反应的 Fe3+的物质的量之比为:
A.4:3B.3:2C.2:3D.1:4
【答案】C
【解析】
铁粉放入三氯化铁溶液中发生反应Fe+2Fe3+=3Fe2+,设已反应的Fe3+的物质的量为2mol,根据方程式计算生成的Fe2+的物质的量,进而得到未反应的Fe3+的物质的量,二者之比即为答案。
设已反应的Fe3+的物质的量为2mol,则:
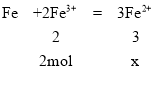
溶液中Fe2+的物质的量为3mol,溶液中的Fe3+和Fe2+浓度相等,所以未反应的Fe3+的物质的量为3mol,
则已反应的Fe3+和未反应的Fe3+的物质的量之比为2mol:3mol=2:3,
故选C。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】下列有关实验的图示及分析均正确的是( )
选项 | 实验目的 | 实验图示 | 实验分析 |
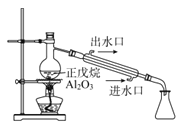
A | 催化裂解正戊烷并收集产物 |
| 正戊烷裂解为分子较小的烷烃和烯烃 |
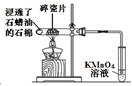
B | 石蜡油的分解并检验产物 |
| 石蜡油分解的 产物含有不饱和烃 |
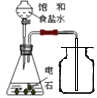
C | 制取并收集乙炔 |
| 用饱和食盐水代替纯水,可达到降低反应速率的目的 |
D | 实验室制硝基苯 |
| 反应完全后,可用仪器a、b蒸馏提纯产品 |
A.AB.BC.CD.D
【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
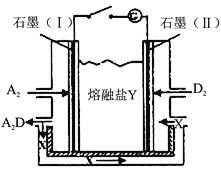
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。