题目内容
20.A、B、C、D、E代表周期表中五种短周期元素,已知:①A、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41.②D与C处于周期表中同一周期,D+中各层电子数都是2n2个.③A、B、C、D、E各元素最外层电子数之和 24,且已知E与A形成两种化合物.据此填写下列空白:
(1)B、C、D三种元素单原子离子的半径由大到小的顺序:S 2->Cl->Na+
(2)B、C、E的氢化物的稳定性由强到弱的顺序:HCl>H2S>CH4
(3)写出A与B组成的化合物与C单质水溶液反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl.
分析 A、B、C、D、E代表周期表中五种短周期元素,D+中各层电子数都是2n2个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则BC都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是a(a为正整数),则B原子序数为a+8,C原子序数为
为a+7或a+9,a+a+8+a+7=41,则a=$\frac{26}{3}$(舍去),a+a+8+a+9=41,a=8,则A是O元素、B是S元素、C是Cl元素;
A、B、C、D、E各元素最外层电子数之和 24,则E最外层电子数=24-6-6-7-1=4,E与O形成两种化合物,则E是C元素;
(1)电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)A、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应.
解答 解:A、B、C、D、E代表周期表中五种短周期元素,D+中各层电子数都是2n2个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则BC都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是a(a为正整数),则B原子序数为a+8,C原子序数为
为a+7或a+9,a+a+8+a+7=41,则a=$\frac{26}{3}$(舍去),a+a+8+a+9=41,a=8,则A是O元素、B是S元素、C是Cl元素;
A、B、C、D、E各元素最外层电子数之和 24,则E最外层电子数=24-6-6-7-1=4,E与O形成两种化合物,则E是C元素;
(1)电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,BCD离子分别是S 2-、Cl-、Na+,硫离子和氯离子有3个电子层、钠离子有2个电子层,所以离子半径大小顺序是S 2->Cl->Na+,
故答案为:S 2->Cl->Na+;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>C,所以氢化物的稳定性HCl>H2S>CH4,故答案为:HCl>H2S>CH4;
(3)A、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl,反应方程式为SO2+Cl2+2H2O=H2SO4+2HCl,故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查位置结构性质相互关系及应用,侧重考查学生推断及知识运用能力,涉及氧化还原反应、元素周期律等知识点,正确判断元素是解本题关键,注意氯气和二氧化硫水溶液的反应,题目难度不大.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 难溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.乙酸过量的原因是提高乙酸丁酯的产率装置C中冷凝管的作用是使挥发的乙酸和丁醇冷凝回流.
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)B装置中冷凝水由b口进入(选填“a”或“b”).
(5)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(选填“上”或“下”)层.
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是氨水 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
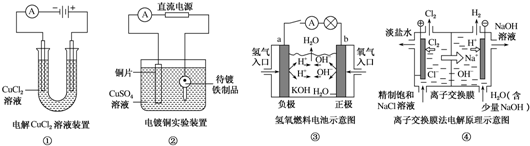
| A. | ①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝 | |
| B. | ②装置中待镀铁制品应与电源正极相连 | |
| C. | ③装置中电子由b极流向a极 | |
| D. | ④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
| A. | 1.2mol | B. | 1.1mol | C. | 1.8 mol | D. | 1.6mol |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |

 .
. ;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl. 根据所学知识回答下列问题,在如图所示装置中
根据所学知识回答下列问题,在如图所示装置中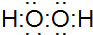 .
. .
. .
. .
.