题目内容
【题目】下列实验中,所选装置或实验设计合理的是( )
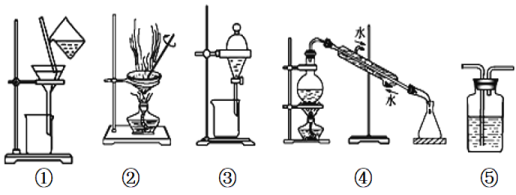
A.用图①和②所示装置可以除去NaCl中的CaCO3杂质,并获得NaCl固体
B.用乙醇提取溴水中的溴选择图③所示装置
C.用图④所示装置可以分离乙醇水溶液
D.图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
【答案】A
【解析】
A.①和②所示装置分别是过滤和蒸发,由于碳酸钙难溶于水,碳酸钠易溶于水,因此用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体,选项A正确;
B.乙醇与水互溶,不能用乙醇提取溴水中的溴,选项B错误;
C.因为缺少温度计,所以不能用图④所示装置分离乙醇水溶液,选项C错误;
D.应该用饱和NaHSO3溶液除去SO2中含有的少量HC1,选项D错误。
答案选A。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H=-92.4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收 c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
下列说法正确的是( )
A. 2c1>c3B. a+b=92.4C. 2p2<p3D. ![]() 1+
1+![]() 3>1
3>1






