题目内容
15.将1L 1mol•L-1碳酸钠溶液逐滴滴入1L 1.5mol•L-1盐酸中,与将1L 1.5mol•L-1盐酸逐滴滴入1Lmol•L-1碳酸钠溶液中,相同条件下,两种操作理论上产生的气体的体积比为( )| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
分析 Na2CO3与稀盐酸反应要分步进行,
Na2CO3+HCl═NaHCO3+NaCl…①
NaHCO3+HCl═NaCl+CO2↑+H2O…②,
根据滴加顺序不同,反应也不同,现象不同,根据方程式进行计算.
解答 解:把Na2CO3溶液逐滴加到盐酸中,开始时盐酸过量,则发生反应Na2CO3+2HCl═2NaCl+H2O+CO2↑,开始就有气体放出,
Na2CO3 +2HCl═2NaCl+H2O+CO2↑
1mol 1.5mol 0.75mol
若将盐酸滴到Na2CO3溶液中,开始时Na2CO3过量,只发生反应①Na2CO3+HCl=NaHCO3+NaCl,无气体,只有在Na2CO3全部转化成NaHCO3后再滴加盐酸才有气体放出.
Na2CO3 +HCl═NaHCO3 +NaCl
1mol 1.5mol 1mol
NaHCO3 +HCl═NaCl+CO2↑+H2O
1mol 0.5mol 0.5mol
所以现象不同,所得气体的体积不等,两种操作产生的CO2的体积比为3:2;
故选:B.
点评 本题主要考查了Na2CO3与盐酸的反应,试剂的滴加顺序不同,产物不同,现象也不同,因此,可用滴加顺序不同来鉴别Na2CO3和盐酸.

练习册系列答案
相关题目
5.如图所示的家庭小实验中,主要发生物理变化的是( )
| A. |  生成炭黑的实验 | B. |  净水 | ||
| C. | 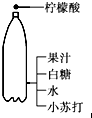 自制汽水 | D. |  将鸡蛋壳放入醋中 |
6.下列离子:①SO${\;}_{3}^{2-}$ ②S2- ③HCO${\;}_{3}^{-}$ ④CO${\;}_{3}^{2-}$ ⑤SO${\;}_{4}^{2-}$ ⑥I- ⑦NH${\;}_{4}^{+}$ ⑧SiO${\;}_{3}^{2-}$ ⑨Fe2+ ⑩Cl-,其中能在稀H2SO4溶液中能大量存在的是( )
| A. | ①②③④⑥⑧⑨ | B. | ⑤⑥⑦⑩ | C. | ⑤⑥⑦⑨⑩ | D. | ⑤⑦ |
10.等物质的量的N2、O2、CO2 混合气体通过Na2O2 后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2 物质的量之比为( )
| A. | 3:4:1 | B. | 3:3:2 | C. | 6:7:3 | D. | 6:9:0.5 |
7.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1 AlC13溶液中:H+、Na+、Cl-、NO3- | |
| B. | 含有0.1mol•L-1 Fe3+的溶液中:Na+、K+、SCN-、SO42- | |
| C. | c(H+)=0.1 mol•L-1的溶液:Na+、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、S2O${\;}_{3}^{2-}$ | |
| D. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
5.化学与人类生产,生活密切相关.下列有关说法不正确的是( )
| A. | 绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 | |
| B. | 碳酸氢钠可用于制备纯碱,治疗胃酸过多的药物,食品发酵剂 | |
| C. | 医用酒精使用淀粉类植物发酵经蒸馏制成,浓度通常为75% | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 |