题目内容
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程
式为:2MnO4- +16H+ + 5Na2O2 ="===" 2Mn2+ +5O2↑ + 8H2O + 10Na+ 下列判断正确的是:
式为:2MnO4- +16H+ + 5Na2O2 ="===" 2Mn2+ +5O2↑ + 8H2O + 10Na+ 下列判断正确的是:
| A.高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂 |
| B.反应的氧化产物只有氧气 |
| C.当反应产生标准状况下2.24 L O2时,反应转移的电子为0.1mol |
| D.向高锰酸钾溶液滴加浓盐酸可以得到酸性高锰酸钾溶液 |
B
该反应中高锰酸根中Mn从+7到+2价,做氧化剂,过氧化钠中O从-1价到0价,做还原剂。故A错误,B正确;该反应中转移10个电子,生成5mol氧气,故生成2.24L氧气,转移0.2mol电子,C错误;盐酸具有还原性,高锰酸钾具有强氧化性,不能用于酸化。

练习册系列答案
相关题目
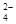 和Cr2O
和Cr2O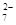 中Cr元素的化合价相同。
中Cr元素的化合价相同。 、LiH遇水均能剧烈分解释放出H2,LiAlH4在125℃时分解为LiH、H2和Al。下列说法不正确的是( )
、LiH遇水均能剧烈分解释放出H2,LiAlH4在125℃时分解为LiH、H2和Al。下列说法不正确的是( )